题目内容
18.羰基硫(COS)可作为一种熏蒸剂,能防止某些昆虫的危害.在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡:CO(g)+H2S(g)?COS(g)+H2(g)K=0.1.反应前CO的物质的量为10mol,平衡后CO物质的量为8mol,下列说法不正确的是( )| A. | 通入CO后,正反应速率逐渐增大 | |
| B. | 升高温度,H2S浓度增加,表明该反应是放热反应 | |
| C. | 反应前H2S物质的量为7mol | |
| D. | CO的平衡转化率为20% |
分析 A.通入CO后,正反应速率瞬间增大,又逐渐减小;
B.升高温度,H2S浓度增加,说明平衡逆向移动,升高温度,平衡向吸热反应方向移动;
C.反应前CO的物质的量为10mol,平衡后CO物质的量为8mol,设反应前H2S物质的量为n,则:
CO(g)+H2S(g)?COS(g)+H2(g)
起始(mol):10 n 0 0
变化(mol):2 2 2 2
平衡(mol):8 n-2 2 2
反应恰好气体分子数目不变,利用物质的量代替浓度代入平衡常数表达式计算;
D.根据C中的计算数据计算CO的平衡转化率.
解答 解:A.通入CO后,正反应速率瞬间增大,又逐渐减小,故A错误;
B.升高温度,H2S浓度增加,说明平衡逆向移动,升高温度,平衡向吸热反应方向移动,则该反应是放热反应,故B正确;
C.反应前CO的物质的量为10mol,平衡后CO物质的量为8mol,设反应前H2S物质的量为n,则:
CO(g)+H2S(g)?COS(g)+H2(g)
起始(mol):10 n 0 0
变化(mol):2 2 2 2
平衡(mol):8 n-2 2 2
反应恰好气体分子数目不变,可以利用物质的量代替浓度计算平衡常数,则平衡常数K=$\frac{2×2}{8×(n-2)}$=0.1,解得:n=7,故C正确;
D.根据上述数据,可知CO的平衡转化率为:$\frac{2mol}{10mol}$×100%=20%,故D正确;
故选A.
点评 本题考查化学平衡的计算,题目难度中等,涉及影响化学反应速率的因素、化学平衡常数应用、化学平衡的有关计算,注意理解掌握三段式均解题法在化学平衡计算中的应用,试题培养了学生的分析能力及化学计算能力.

| A. | 增大C的量,H2O的转化率增大 | |
| B. | 减小容器体积,正、逆反应速率均减小 | |
| C. | 加入催化剂,平衡常数不变 | |
| D. | 升高温度,平衡向逆反应方向移动 |
| A. | 由C(s,石墨)═C(s,金钢石)△H>0可知,金刚石比石墨稳定 | |
| B. | CO(g)燃烧热是283.0 kJ•mol-1,则2CO2(g)═2CO(g)+O2(g)△H=+566.0kJ•mol-1 | |
| C. | CH4(g)+2O2(g)═CO2+2H2O(I)△H<0,该反应的化学能可以转化为电能 | |
| D. | 已知C(s)+O2(g)═CO2(g)△H1,C(s)+$\frac{1}{2}$O2(g)═CO(g)△H2,则)△H1<△H2 |
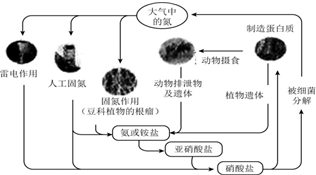
| A. | 上述氮循环中氮元素均被氧化 | |
| B. | 打雷闪电时涉及的一个反应为N2+2O2═2NO2 | |
| C. | 含氮无机物和含氮有机物可相互转化 | |
| D. | 自然界氮循环中氮元素的质量增加了 |
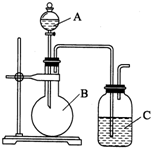 某同学设计如图装置,探究非金属性质变化规律.
某同学设计如图装置,探究非金属性质变化规律.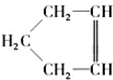 ,可简写为
,可简写为 ,降冰片烯的分子结构可表示为
,降冰片烯的分子结构可表示为 .
. .(任选一种)
.(任选一种) .
. A、B、C、D、E五种物质中均含有同一种非金属元素,它们能发生如图所示的转化关系,该元素(用R)表示)的单质能与NaOH溶液反应生成盐(Na2RO3)和氢气.
A、B、C、D、E五种物质中均含有同一种非金属元素,它们能发生如图所示的转化关系,该元素(用R)表示)的单质能与NaOH溶液反应生成盐(Na2RO3)和氢气.