题目内容
8. A、B、C、D、E五种物质中均含有同一种非金属元素,它们能发生如图所示的转化关系,该元素(用R)表示)的单质能与NaOH溶液反应生成盐(Na2RO3)和氢气.
A、B、C、D、E五种物质中均含有同一种非金属元素,它们能发生如图所示的转化关系,该元素(用R)表示)的单质能与NaOH溶液反应生成盐(Na2RO3)和氢气.(1)写出各物质的化学式:ASiO2;CNa2SiO3.
(2)写出反应①的化学方程式2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO该反应中氧化剂与还原剂的物质的量之比为1:2.
(3)写出反应④的离子方程式:Si+2OH-+H2O=SiO32-+2H2↑.
(4)写出反应⑤的离子方程式SiO32-+Ca2+=CaSiO3↓.
(5)H2CO3的酸性强于E的酸性,请用离子方程式予以证明:SiO32-+CO2+H2O=H2SiO3↓+CO32-.
分析 非金属单质R能与NaOH溶液反应生成盐(Na2RO3)和氢气,则R为Si元素,由转化关系可知D为Si,A为SiO2,B为CaSiO3,C为Na2SiO3,E为H2SiO3,结合对应物质的性质以及题目要求解答该题.
解答 解:非金属单质R能与NaOH溶液反应生成盐(Na2RO3)和氢气,则R为Si元素,由转化关系可知D为Si,A为SiO2,B为CaSiO3,C为Na2SiO3,E为H2SiO3,
(1)由以上分析可知A为SiO2,C为Na2SiO3,故答案为:SiO2;Na2SiO3;
(2)反应①的化学方程式为2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO,根据方程式可知,该反应中氧化剂与还原剂的物质的量之比为1:2,
故答案为:2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO;1:2;
(3)反应④的离子方程式为Si+2OH-+H2O=SiO32-+2H2↑,故答案为:Si+2OH-+H2O=SiO32-+2H2↑;
(4)反应⑤的离子方程式为SiO32-+Ca2+=CaSiO3↓,故答案为:SiO32-+Ca2+=CaSiO3↓;
(5)H2CO3的酸性强于H2SiO3的酸性,可在硅酸钠溶液中通入二氧化碳,如生成硅酸沉淀,可说明,反应的离子方程式为SiO32-+CO2+H2O=H2SiO3↓+CO32-,
故答案为:SiO32-+CO2+H2O=H2SiO3↓+CO32-.
点评 本题以硅为载体考查了无机物的推断,为高考常见题型,侧重于学生的分析能力的考查,根据硅、二氧化硅、硅酸盐之间的转化关系来分析解答,注意:二氧化硅和碳在高温下反应生成CO而不是二氧化碳,为易错点.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
18.羰基硫(COS)可作为一种熏蒸剂,能防止某些昆虫的危害.在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡:CO(g)+H2S(g)?COS(g)+H2(g)K=0.1.反应前CO的物质的量为10mol,平衡后CO物质的量为8mol,下列说法不正确的是( )
| A. | 通入CO后,正反应速率逐渐增大 | |
| B. | 升高温度,H2S浓度增加,表明该反应是放热反应 | |
| C. | 反应前H2S物质的量为7mol | |
| D. | CO的平衡转化率为20% |
19.下列反应中,反应后固体物质质量增加的是( )
| A. | 氢气通过灼热的Cu0粉末 | B. | 二氧化碳通过Na202粉末 | ||
| C. | 铝粉与Fe203粉末发生铝热反应 | D. | 将锌粉投入CuSO4溶液 |
16.有A.B.C.D.E五种短周期主族元素,原子序数依次增大,其中A是宇宙中含量最高的元素,其原子核中无中子,B,D同主族,且B、D最外层电子数之和与A、C的质子数之和相等.C是同周期中原子半径最大的主族元素,下列说法不正确的是( )
| A. | E的单质不具有漂白能力 | |
| B. | A2D与DB2可发生氧化还原反应,氧化产物与还原产物的质量比为2:1 | |
| C. | A2D的还原性弱于AE的还原性 | |
| D. | B与C形成的两种离子化合物中,阴、阳离子个数比相等且所含化学键类型不完全相同 |
13.A%为气态反应物在平衡体系中的百分含量,符合曲线的反应是( )
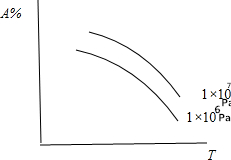

| A. | N2(气)+3H2(气)?2NH3(气);△H<0 | B. | C(固)+CO2(气)?2CO(气);△H>0 | ||
| C. | N2(气)十O2(气)?2N0(气);△H>0 | D. | CaCO3(固)?CaO(固)+CO2(气);△H>0 |
20.能在水溶液中大量共存的一组离子是( )
| A. | H+、I-、NO3-、SiO32- | B. | Ag+、Fe3+、Cl-、SO42- | ||
| C. | K+、Cu2+、SO42-、NO3- | D. | NH4+、OH-、Cl-、HCO3- |
18.在实验室进行教材中重点演示实验,括号内的实验仪器或试剂都能用到的是( )
| A. | 蔗糖的水解(试管、蔗糖溶液、新制的Cu(OH)2悬浊液) | |
| B. | 用NaOH标准溶液确定未知浓度的硫酸溶液(石蕊试液、碱式滴定管、锥形瓶) | |
| C. | 证明海带中存在碘元素(漏斗、稀硫酸、氯气、玻璃棒) | |
| D. | 制氢氧化铁胶体(饱和FeCl3溶液、NaOH溶液、胶头滴管) |