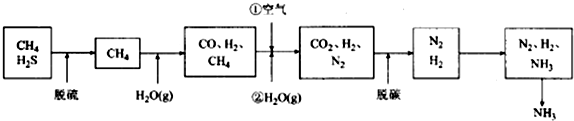
题目内容
3.(1)某温度(t℃)时,水的Kw=10-13,则该温度大于(填:“大于”“小于”或“等于”)25℃;将此温度下pH=12的NaOH溶液aL与pH=1的硫酸溶液bL混合,若所得混合溶液的pH=2(忽略溶液混合后的体积变化),则a:b=9:11;(2)已知25℃时,0.1mol•L-1醋酸溶液的pH约为3,如果在此溶液中加入等体积的pH=5的盐酸,则醋酸的电离平衡将向右(填“向左”、“向右”、“不”)移动;若向原醋酸溶液中加入少量醋酸钠晶体,待晶体完全溶解后溶液的pH将增大(填“增大”、“减小”、“不变”)
(3)纯碱是常见的生活用品,也是重要的化工原料,常温时,在1.0mol•L-1的纯碱溶液中,除H+外,其他各离子的浓度由大到小的顺序为:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)(用含“>”的符号表示);
(4)盐类水解在实际生产生活中有重要的用途.常用的泡沫灭火器就是利用了小苏打和硫酸铝溶液的反应原理来灭火,写出该反应的离子方程式:2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑.
分析 (1)水的电离是吸热反应,升高温度促进水电离;该温度下,pH=12的NaOH溶液中c(NaOH)=c(OH-)=$\frac{1{0}^{-13}}{1{0}^{-12}}$mol/L=0.1mol/L,pH=1的稀硫酸中c(H+)=0.1mol/L,如果混合溶液pH=2,则混合溶液中c(H+)=0.01mol/L,c(H+)=$\frac{c({H}^{+})V({H}^{+})-c(O{H}^{-})V(O{H}^{-})}{V({H}^{+})+V(O{H}^{-})}$;
(2)如果在此溶液中加入等体积的pH为5的盐酸相当于稀释醋酸溶液,平衡正向进行;加入醋酸钠晶体,溶解后抑制电离,氢离子浓度减小,pH增大;
(3)Na2CO3为强碱弱酸盐,水解呈碱性,在溶液中存在CO32-+H2O?HCO3-+OH-,Na2CO3溶液中存在c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+);
(4)碳酸钠与强酸弱碱盐氯化铝发生双水解反应,以此来解答.
解答 解:(1)水的电离是吸热反应,升高温度促进水电离,t℃时水的离子积为1×10-13>1×10-14,则该温度大于25℃;
该温度下,pH=12的NaOH溶液中c(NaOH)=c(OH-)=$\frac{1{0}^{-13}}{1{0}^{-12}}$mol/L=0.1mol/L,pH=1的稀硫酸中c(H+)=0.1mol/L,如果混合溶液pH=2,则混合溶液中c(H+)=0.01mol/L,c(H+)=$\frac{c({H}^{+})V({H}^{+})-c(O{H}^{-})V(O{H}^{-})}{V({H}^{+})+V(O{H}^{-})}$=$\frac{0.1mol/L×bL-0.1mol/L×aL}{aL+bL}$=0.01mol/L,a:b=9:11,
故答案为:大于;9:11;
(2)已知25℃时0.1mol•L-1醋酸溶液达到平衡(CH3COOH?H++CH3COO-)时的pH约为3,如果在此溶液中加入等体积的pH为5的盐酸相当于稀释醋酸溶液,平衡正向进行;加入醋酸钠晶体,溶解后抑制电离,氢离子浓度减小,pH增大;
故答案为:向右;增大;
(3)Na2CO3为强碱弱酸盐,水解呈碱性,在溶液中存在CO32-+H2O?HCO3-+OH-,HCO3-+H2O?H2CO3+OH-,因CO32-水解水解显碱性,且第一步水解大于第一步电离,则离子浓度关系为:c(Na+)>c(CO32-)>c(OH-)>c (HCO3-);故答案为:c(Na+)>c(CO32-)>c(OH-)>c (HCO3-);
(4)碳酸钠与强酸弱碱盐氯化铝发生双水解反应,生成CO2灭火.即2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑
点评 本题考查了电离与水解方程式的书写,为高频考点,注意遵循电荷守恒和质量守恒定律,把握发生的化学反应及电解质的强弱及电离特点是解答的关键,题目难度中等.

| 甲 | 乙 | 丙 | 丁 | |
| A | 2 | 1 | 2 | 1 |
| B | 1 | 1 | 2 | 2 |
| A. | A的转化率为:甲<丙<乙<丁 | B. | A的转化率为:甲<乙<丙<丁 | ||
| C. | B的转化率为:甲>丙>乙>丁 | D. | B的转化率为:丁>乙>丙>甲 |
| A. | 酸式滴定管在装酸液前未用待装液润洗2~3次,使测定结果偏大 | |
| B. | 滴定终点时,俯视读数,使测定结果偏小 | |
| C. | 只能选用酚酞作指示剂 | |
| D. | 滴入最后一滴NaOH溶液,溶液突然变色,即为滴定终点 |
| A. | 通入CO后,正反应速率逐渐增大 | |
| B. | 升高温度,H2S浓度增加,表明该反应是放热反应 | |
| C. | 反应前H2S物质的量为7mol | |
| D. | CO的平衡转化率为20% |
| A | B | C | D | |
| 物质的 化学式 | NaOH(浓) | C2H5OH(酒精) | H2SO4 (浓) | NH4NO3 |
| 危险警 告标签 |  |  |  |  |
| A. | A | B. | B | C. | C | D. | D |
| A. | NH3通入AlCl3溶液中 | B. | Cu与硝酸反应 | ||
| C. | CO2通入NaOH溶液中 | D. | Na与O2反应 |
| A. | 胶体 | B. | 溶液 | C. | 悬浊液 | D. | 乳浊液 |
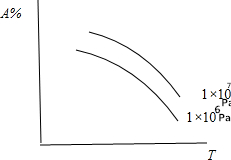
| A. | N2(气)+3H2(气)?2NH3(气);△H<0 | B. | C(固)+CO2(气)?2CO(气);△H>0 | ||
| C. | N2(气)十O2(气)?2N0(气);△H>0 | D. | CaCO3(固)?CaO(固)+CO2(气);△H>0 |