题目内容
五种短周期元素A﹑B﹑C﹑D﹑E的原子序数依次增大,A和C同族,B和D同族,C离子和B离子具有相同的电子层结构,A和B﹑D﹑E均能形成共价型化合物.A和B形成的化合物在水中呈碱性,E是同周期元素中原子半径最小的元素.请用化学用语回答下列问题:
(1)五种元素中,原子半径最大的是 ,最高价氧化物水化物酸性最强的是
(2)由A和B﹑D﹑E所形成的共价型化合物中,热稳定性最差的是
(3)A和E形成的化合物与A和B形成的化合物反应,反应现象为 ,产物的化学式为 其中存在的化学键类型为
(4)由A﹑B两元素形成的个数比为1:2的化合物数环境友好型高能燃料,可作为航天飞机的推进剂,电子式为 ;其燃烧的化学方程式为
(5)单质E与水反应的离子方程式为
(6)用电子式表示C和E形成化合物的过程 .
(1)五种元素中,原子半径最大的是
(2)由A和B﹑D﹑E所形成的共价型化合物中,热稳定性最差的是
(3)A和E形成的化合物与A和B形成的化合物反应,反应现象为
(4)由A﹑B两元素形成的个数比为1:2的化合物数环境友好型高能燃料,可作为航天飞机的推进剂,电子式为
(5)单质E与水反应的离子方程式为
(6)用电子式表示C和E形成化合物的过程
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:五种短周期元素A﹑B﹑C﹑D﹑E的原子序数依次增大,A和B形成的化合物在水中呈碱性,则化合物为氨气,则A为H,B为N;A和C同族,B和D同族,C离子和B离子具有相同的电子层结构,则C为Na,D为P;A和B﹑D﹑E均能形成共价型化合物,E是同周期元素中原子半径最小的元素,E为Cl,
(1)电子层越少,原子半价越小;非金属性越强,最高价氧化物水化物酸性越强;
(2)非金属性越弱,气态氢化物越不稳定;
(3)HCl与氨气反应生成氯化铵;
(4)由A﹑B两元素形成的个数比为1:2的化合物为N2H4;
(5)氯气与水反应生成盐酸和次氯酸;
(6)C和E形成化合物为NaCl,为离子化合物.
(1)电子层越少,原子半价越小;非金属性越强,最高价氧化物水化物酸性越强;
(2)非金属性越弱,气态氢化物越不稳定;
(3)HCl与氨气反应生成氯化铵;
(4)由A﹑B两元素形成的个数比为1:2的化合物为N2H4;
(5)氯气与水反应生成盐酸和次氯酸;
(6)C和E形成化合物为NaCl,为离子化合物.
解答:
解:五种短周期元素A﹑B﹑C﹑D﹑E的原子序数依次增大,A和B形成的化合物在水中呈碱性,则化合物为氨气,则A为H,B为N;A和C同族,B和D同族,C离子和B离子具有相同的电子层结构,则C为Na,D为P;A和B﹑D﹑E均能形成共价型化合物,E是同周期元素中原子半径最小的元素,E为Cl,
(1)上述元素中,Na原子半价最大,Cl的非金属性最强,则最高价氧化物水化物酸性最强的是HClO4,故答案为:Na;HClO4;
(2)非金属性Cl>P,N>P,则热稳定性最差的是为PH3,故答案为:PH3;
(3)HCl与氨气反应生成氯化铵,观察到冒白烟,生成物为NH4Cl,含离子键、共价键,故答案为:冒白烟;NH4Cl;离子键和共价键;
(4)由A﹑B两元素形成的个数比为1:2的化合物为N2H4;,电子式为 ,燃烧反应为N2H4+O2
,燃烧反应为N2H4+O2
N2+2H2O,
故答案为: ;N2H4+O2
;N2H4+O2
N2+2H2O;
(5)氯气与水反应的离子反应为Cl2+H2O═H++Cl-+HClO,故答案为:Cl2+H2O═H++Cl-+HClO;
(6)氯化钠的形成过程为 ,
,
故答案为: .
.
(1)上述元素中,Na原子半价最大,Cl的非金属性最强,则最高价氧化物水化物酸性最强的是HClO4,故答案为:Na;HClO4;
(2)非金属性Cl>P,N>P,则热稳定性最差的是为PH3,故答案为:PH3;
(3)HCl与氨气反应生成氯化铵,观察到冒白烟,生成物为NH4Cl,含离子键、共价键,故答案为:冒白烟;NH4Cl;离子键和共价键;
(4)由A﹑B两元素形成的个数比为1:2的化合物为N2H4;,电子式为
 ,燃烧反应为N2H4+O2
,燃烧反应为N2H4+O2
| ||
故答案为:
 ;N2H4+O2
;N2H4+O2
| ||
(5)氯气与水反应的离子反应为Cl2+H2O═H++Cl-+HClO,故答案为:Cl2+H2O═H++Cl-+HClO;
(6)氯化钠的形成过程为
 ,
,故答案为:
 .
.
点评:本题考查位置、结构与性质的关系及应用,为高频考点,把握元素的位置、性质推断元素为解答的关键,侧重分析、推断及应用能力的综合考查,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
对于相同温度和压强下,1mol O2和1mol O3相比较,下列说法错误的是( )
| A、体积相同,但不一定是22.4L |
| B、分子数相同,但原子数不同 |
| C、摩尔质量不同,但质量相同 |
| D、质子数不同,电子数也不同 |
在碱性溶液中能大量共存且溶液为无色透明的离子组是( )
| A、K+、MnO4-、Na+、Cl- |
| B、K+、Na+、NO3-、CO32- |
| C、Na+、H+、NO3-、SO42- |
| D、Mg2+、Na+、Cl-、SO42- |
常温下,下列各溶液中微粒的物质的量浓度关系正确的是( )
| A、0.1 mol?L-1的Na2CO3溶液中:c(OH-)=c(HCO3-)+c(H+)+c(H2CO3) |
| B、NaA溶液的pH=8,c(Na+)-c(A-)=9.9×10-7 mol?L-1 |
| C、将0.1mol/L的Na2S溶液与0.1mol/L的NaHS溶液等体积混合,所得溶液中:c(OH-)=c(H+)+c(S2-)+2c(HS-)+3c(H2S) |
| D、将25mL0.2mol/L的盐酸与100mL0.1mol/L的氨水混合,所得溶液中:c(Cl-)>c(NH4+)>c(NH3?H2O)>c(OH-)>c(H+) |
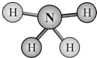 肼(H2N-NH2)和偏二甲肼[H2N-N(CH3)2]均可用作火箭燃料.查阅资料得知,肼是一种良好的极性溶剂,沿肼分子球棍模型的氮、氮键方向观察,看到的平面图如图所示.下列说法不正确的是( )
肼(H2N-NH2)和偏二甲肼[H2N-N(CH3)2]均可用作火箭燃料.查阅资料得知,肼是一种良好的极性溶剂,沿肼分子球棍模型的氮、氮键方向观察,看到的平面图如图所示.下列说法不正确的是( )| A、肼分子中的氮原子采用sp3杂化 |
| B、肼分子中既有极性键又有非极性键 |
| C、肼分子是非极性分子 |
| D、肼与偏二甲肼互称同系物 |
 A、B、C、D、E五种元素其核电荷数依次增大.A原子只有1个s电子,B原子L层中s电子和p电子数目相同,B、C、D属于同周期且相邻,E原子内层均饱和,N层上只有两个电子.
A、B、C、D、E五种元素其核电荷数依次增大.A原子只有1个s电子,B原子L层中s电子和p电子数目相同,B、C、D属于同周期且相邻,E原子内层均饱和,N层上只有两个电子.