题目内容
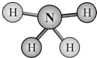 肼(H2N-NH2)和偏二甲肼[H2N-N(CH3)2]均可用作火箭燃料.查阅资料得知,肼是一种良好的极性溶剂,沿肼分子球棍模型的氮、氮键方向观察,看到的平面图如图所示.下列说法不正确的是( )
肼(H2N-NH2)和偏二甲肼[H2N-N(CH3)2]均可用作火箭燃料.查阅资料得知,肼是一种良好的极性溶剂,沿肼分子球棍模型的氮、氮键方向观察,看到的平面图如图所示.下列说法不正确的是( )| A、肼分子中的氮原子采用sp3杂化 |
| B、肼分子中既有极性键又有非极性键 |
| C、肼分子是非极性分子 |
| D、肼与偏二甲肼互称同系物 |
考点:不同晶体的结构微粒及微粒间作用力的区别
专题:化学键与晶体结构
分析:A.根据价层电子对互斥理论确定N原子杂化类型,如果N原子价层电子对个数是4,则N原子采用sp3杂化;
B.同种非金属元素之间易形成非极性键,不同非金属元素之间易形成极性键;
C.结构对称,正负电荷重心重合的分子为非极性分子;
D.结构相似,在分子组成上相差一个或若干个-CH2原子团的有机化合物互称同系物.
B.同种非金属元素之间易形成非极性键,不同非金属元素之间易形成极性键;
C.结构对称,正负电荷重心重合的分子为非极性分子;
D.结构相似,在分子组成上相差一个或若干个-CH2原子团的有机化合物互称同系物.
解答:
解:A.肼分子中每个N原子含有3个σ键和1个孤电子对,所以其价层电子对个数是4,则N原子采用sp3杂化,故A正确;
B.肼分子中N原子之间存在非极性键,N原子和H原子之间存在极性键,所以该反应中既有极性键又有非极性键,故B正确;
C.肼分子结构不对称,则正负电荷重心不重合,所以是极性分子,故C错误;
D.肼和偏二甲肼结构相似,在分子组成上相差2个-CH2原子团,属于同系物,故D正确;
故选C.
B.肼分子中N原子之间存在非极性键,N原子和H原子之间存在极性键,所以该反应中既有极性键又有非极性键,故B正确;
C.肼分子结构不对称,则正负电荷重心不重合,所以是极性分子,故C错误;
D.肼和偏二甲肼结构相似,在分子组成上相差2个-CH2原子团,属于同系物,故D正确;
故选C.
点评:本题侧重考查基本概念、基本理论等知识点,明确同系物、非极性分子、极性键和非极性键等基本概念内涵即可解答,原子杂化方式的判断是考试热点,要熟练掌握.

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目
在下列化学方程式中,不能用离子方程式Ba2++SO42-=BaSO4↓表示的是( )
| A、BaCl2+H2SO4=BaSO4↓+2HCl |
| B、Ba(OH)2+Na2SO4=BaSO4↓+2NaOH |
| C、Ba(NO3)2+H2SO4=BaSO4↓+2HNO3 |
| D、Ba(OH)2+H2SO4=BaSO4↓+2H2O |
金属钛对体液无毒且惰性,能与肌肉和骨骼生长在一起,有“生物金属”之称.下列有关
Ti和
Ti的说法中正确的是( )
48 22 |
50 22 |
A、
| ||||
B、
| ||||
C、
| ||||
D、分别由
|
下列反应的离子方程式正确的是( )
| A、氧化铜与硫酸混合:O2-+2H+=H2O |
| B、澄清的石灰水跟盐酸反应:Ca2++2Cl-=CaCl2 |
| C、Fe和盐酸反应:2Fe+6H+=2Fe3++3H2↑ |
| D、石灰石和盐酸反应:CaCO3+2H+=Ca2++CO2↑+H2O |
下列离子方程式正确的是( )
| A、铁粉与稀盐酸反应Fe+2H+=Fe3++H2↑ |
| B、少量金属钠放入冷水中:Na+2H2O=Na++2OH-+H2↑ |
| C、氧化铜溶于硫酸:O2-+2H+=H2O |
| D、碳酸钙溶于醋酸CaCO3+2CH3COOH=Ca2++2CH3COO-+H2O+CO2↑ |
 某研究性学习小组的同学在实验室对Cl2使有色物质褪色的机理进行了探究.
某研究性学习小组的同学在实验室对Cl2使有色物质褪色的机理进行了探究.