题目内容
16.将4molA气体和2molB气体在2L的容器中混合,并在一定条件下发生如下反应:2A(g)+B(g)?2C(g).若经2s后测得C的浓度为0.6mol•L-1,现有下列几种说法:①用物质A表示的反应的平均速率为0.3mol•L-1•s-1;
②用物质B表示的反应的平均速率为0.6mol•L-1•s-1;
③2s时物质A的转化率为30%;
④2s时物质B的浓度为1.4mol•L-1.
其中正确的是( )
| A. | ①③ | B. | ①④ | C. | ②③ | D. | ③④ |
分析 若经2s后测得C的浓度为0.6mol•L-1,则
2A(g)+B(g)?2C(g)
开始 2 1 0
转化 0.6 0.3 0.6
2s 1.4 0.7 0.6
结合v=$\frac{△c}{△t}$、转化率=$\frac{转化的量}{开始的量}$×100%计算.
解答 解:若经2s后测得C的浓度为0.6mol•L-1,则
2A(g)+B(g)?2C(g)
开始 2 1 0
转化 0.6 0.3 0.6
2s 1.4 0.7 0.6
①用物质A表示的反应的平均速率为$\frac{0.6mol/L}{2s}$=0.3mol•L-1•s-1,故正确;
②用物质B表示的反应的平均速率为$\frac{0.3mol/L}{2s}$=0.15mol•L-1•s-1,故错误;
③2s时物质A的转化率为$\frac{0.6}{2}$×100%=30%,故正确;
④2s时物质B的浓度为0.7mol•L-1,故错误;
故选A.
点评 本题考查化学平衡的计算,为高频考点,把握化学平衡三段法、反应速率及转化率的计算为解答的关键,侧重分析与计算能力的考查,注意反应中浓度的关系,题目难度不大.

练习册系列答案
相关题目
5.向甲、乙两个容积均为1L的恒容容器中,分别充入2mol A、2mol B和1mol A、1mol B.相同条件下(温度为T),发生下列反应:A(g)+B(g)?xC(g)△H<0.测得两容器中c(A)随时间t的变化如图所示,下列说法正确的是( )
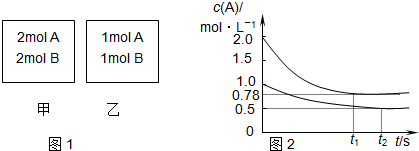

| A. | x=1 | |
| B. | 将乙容器单独升温可使乙容器内各物质的体积分数与甲容器内的相同 | |
| C. | 若向甲容器中再充入2 mol A、2 mol B,则平衡时甲容器中:0.78 mol•L-1<c(A)<1.56 mol•L-1 | |
| D. | 若甲容器为等压可变容器,向甲中充入惰性气体,则c(A)减小,平衡正向移动,v(正)、v(逆)减 |
7.下列关于化学反应类型的叙述中,正确的是( )
| A. | 凡是生成盐和水的反应都是中和反应 | |
| B. | 两种酸之间一定不能发生反应 | |
| C. | 生成一种单质和一种化合物的反应一定是置换反应 | |
| D. | 复分解反应一定没有单质参加 |
4.下列有关化学键与晶体结构说法正确的是( )
| A. | 两种元素组成的分子一定只有极性键 | |
| B. | 非金属元素组成的化合物一定是共价化合物 | |
| C. | 对于组成结构相似的分子晶体,相对分子质量越大,熔沸点一定越高 | |
| D. | 含阴离子的化合物一定有阳离子 |
11.下列叙述错误的是( )
| A. | 用AgNO3溶液可以鉴别KCl和KI | |
| B. | 制备乙酸乙酯时可用饱和Na2CO3溶液收集产物以除去其中的乙酸 | |
| C. | 制氯气时,用饱和NaHCO3溶液和浓硫酸净化气体 | |
| D. | SO2使溴水褪色与乙烯使KMnO4溶液褪色的原理相同 |
8.下列说法正确的是( )
| A. | 将AlCl3溶液和Al2(SO4)3溶液分别加热、蒸干、灼烧,所得固体成分相同 | |
| B. | 配制FeSO4溶液时,将FeSO4固体溶于稀盐酸中,然后稀释至所需浓度 | |
| C. | 用分液的方法分离乙醇和水的混合溶液 | |
| D. | 洗涤油污常用热的Na2CO3溶液 |
5.下列与金属腐蚀有关的说法,正确的是( )
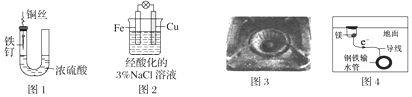

| A. | 图1中,铁钉易被腐蚀 | |
| B. | 图2中,滴加少量K3[Fe(CN)6]溶液,没有蓝色沉淀出现 | |
| C. | 图3中,燃气灶的中心部位容易生锈,主要是由于高温下铁发生化学腐蚀 | |
| D. | 图4中,用牺牲镁块的方法来防止地下钢铁管道的腐蚀,镁块相当于原电池的正极 |
6.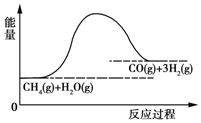 合成氨用的H2可以CH4为原料制得:CH4(g)+H2O(g)═CO(g)+3H2(g).反应过程的能量变化如图所示,关于该反应的下列说法中,正确的是( )
合成氨用的H2可以CH4为原料制得:CH4(g)+H2O(g)═CO(g)+3H2(g).反应过程的能量变化如图所示,关于该反应的下列说法中,正确的是( )
 合成氨用的H2可以CH4为原料制得:CH4(g)+H2O(g)═CO(g)+3H2(g).反应过程的能量变化如图所示,关于该反应的下列说法中,正确的是( )
合成氨用的H2可以CH4为原料制得:CH4(g)+H2O(g)═CO(g)+3H2(g).反应过程的能量变化如图所示,关于该反应的下列说法中,正确的是( )| A. | △H<0,△S<0 | B. | △H>0,△S<0 | C. | △H<0,△S>0 | D. | △H>0,△S>0 |