题目内容
1.A、B、C、D、E五种物质的焰色反应都显黄色,其中A为银白色质软的低熔点金属单质,B为淡黄色的固体化合物,A、B与水反应都有气体放出,A与水反应放出的气体具有还原性,而B与水反应生成的气体可供给呼吸,同时都生成溶液C,C与适量的CO2反应生成D,D溶液与过量的CO2反应生成E,E加热能变成D.(1)写出A~E的化学式:
ANa、BNa2O2、CNaOH、DNa2CO3、ENaHCO3.
(2)E加热生成D的化学方程式是:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O.
(3)C溶液和CO2反应生成D的离子方程式:2OH-+CO2=CO32-+H2O.
分析 A、B、C、D、E五种物质的焰色反应都呈黄色,均含Na元素,A、B与水反应都有气体放出,A与水反应放出的气体具有还原性,B与水反应放出的气体具有氧化性,则A为Na,B为Na2O2,同时都生成溶液C,则C为NaOH,C与适量的CO2反应生成D,D溶液与过量的CO2反应生成E,E加热能够生成D,所以D为Na2CO3,E为NaHCO3,结合物质的性质及化学用语来解答.
解答 解:(1)由上述分析可知,A为Na,B为Na2O2,C为NaOH,D为Na2CO3,E为NaHCO3,
故答案为:Na;Na2O2;NaOH;Na2CO3;NaHCO3;
(2)E加热生成D和F的化学方程式为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,
故答案为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O;
(3)C溶液和CO2反应生成D的离子方程式为:2OH-+CO2=CO32-+H2O,
故答案为:2OH-+CO2=CO32-+H2O.
点评 本题考查Na及其化合物之间的转化,明确焰色反应及氢气具有还原性、氧气具有氧化性推断A、B为解答的关键,题目难度中等.

练习册系列答案
 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目
10.下列叙述正确的是( )
| A. | 将稀硝酸加入过量铁粉中,充分反应后滴加KSCN溶液,溶液呈血红色 | |
| B. | 在溶液中加入K3[Fe(CN)6]溶液,生成蓝色沉淀,证明原溶液中有Fe2+ | |
| C. | 向FeCl3溶液中滴加稀氨水,可制备Fe(OH)3胶体 | |
| D. | Fe2O3$\stackrel{盐酸}{→}$FeCl3(aq)$\stackrel{蒸发、灼烧}{→}$无水FeCl3 |
12.如图所示是验证氯气性质的微型实验,a、b、d、e是浸有相关溶液的滤纸.向KMnO4晶体滴加一滴浓盐酸后,立即用另一培养皿扣在上面.
已知:2KMnO4+16HCl→2KCl+5Cl2↑+2MnCl2+8H2O
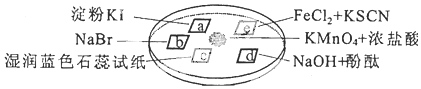
对实验现象的“解释或结论”正确的是( )
已知:2KMnO4+16HCl→2KCl+5Cl2↑+2MnCl2+8H2O

对实验现象的“解释或结论”正确的是( )
| 选项 | 实验现象 | 解释或结论 |
| A | a处变蓝,b处变红棕色 | 氧化性:Cl2>Br2>I2 |
| B | c处先变红,后褪色 | 氯气与水生成了酸性物质 |
| C | d处立即褪色 | 氯气与水生成了漂白性物质 |
| D | e处变红色 | 还原性:Fe2+>Cl- |
| A. | A | B. | B | C. | C | D. | D |
9.下列四组离子中一定能大量共存的是( )
| A. | K+、H+、Cl-、CO32- | B. | Fe3+、Mg2+、NO3-、SCN- | ||
| C. | NO3- H+、Fe2+、SO42- | D. | Na+、OH-、Cl-、NO3- |
6.下列化学概念叙述正确的是( )
| A. | 在标准状况下,1molH2O所占体积约为22.4L | |
| B. | OH-所含电子数是10 | |
| C. | 0.5molH2和0.5molN2体积相同 | |
| D. | 从1L 0.5mol•L-1NaCl溶液中取出200mL溶液,其物质的量浓度为0.1mol•L-1 |
13.在实验室里,要想使AlCl3溶液中的 Al的全部沉淀出来,应选用下列试剂中.( )
| A. | 石灰水 | B. | NaOH 溶液 | C. | 硫酸 | D. | 氨水 |
10.表是元素周期表的一部分,根据所给的10种元素,完成以下各小题..
(1)镁的原子结构示意图为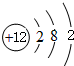 .
.
(2)H2SO4与HClO4中,酸性较强的是HClO4.
(3)NaOH与Al (OH)3中,属于两性氢氧化物的是Al(OH)3.它常用作治疗胃酸(含盐酸)过多的药物,该反应的离子方程式为Al(OH)3+3H+═Al3++3H2O.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 2 | C | N | O | Ne | ||||
| 3 | Na | Mg | Al | Si | S | Cl |
 .
.(2)H2SO4与HClO4中,酸性较强的是HClO4.
(3)NaOH与Al (OH)3中,属于两性氢氧化物的是Al(OH)3.它常用作治疗胃酸(含盐酸)过多的药物,该反应的离子方程式为Al(OH)3+3H+═Al3++3H2O.
11.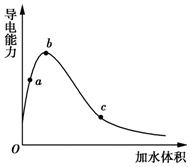 一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如图所示,下列说法正确的是( )
一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如图所示,下列说法正确的是( )
 一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如图所示,下列说法正确的是( )
一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如图所示,下列说法正确的是( )| A. | a、b、c三点溶液的pH:c<a<b | |
| B. | 用湿润的pH试纸测量a处溶液的pH,测量结果偏小 | |
| C. | a、b、c三点CH3COOH的电离程度:c<a<b | |
| D. | a、b、c三点溶液用1 mol•L-1 NaOH溶液中和,消耗NaOH溶液体积:c<a<b |