题目内容
3. 前四周期A、B、C、D、E、F、G原子序数依次增大,A元素的质子数和质量数相等,B元素具有三个能级且所排电子数相同,D元素2p能级上电子数是2s能级的两倍;D和E相邻且同主族.F是第四周期未成对电子最多的原子,G是目前使用量最多的金属.
前四周期A、B、C、D、E、F、G原子序数依次增大,A元素的质子数和质量数相等,B元素具有三个能级且所排电子数相同,D元素2p能级上电子数是2s能级的两倍;D和E相邻且同主族.F是第四周期未成对电子最多的原子,G是目前使用量最多的金属.请回答下列问题:(用推出的元素符号或者化学式作答)
(1)F的价电子排布式为3d54s1,B、C、D三种元素的第一电离能从大到小的顺序为N>O>C,D和E电负性较大的是O>S.
(2)BD32-中B原子的杂化方式为sp2,该离子的空间构型为平面正三角形,键角为120°°.
(3)写出一种由A、C、D组成且既含离子键又含共价键的物质的化学式NH4NO3,化合物ABC中σ键和π键数目之比为1:1,C的气态氢化物在一定的压强下,测得的密度比该压强下理论密度略大,请解释原因NH3通过氢键形成“缔合”分子,导致相对分子质量增大,分子间作用力增强,分子间距离减小,导致密度反常增大.
(4)B和C的最高价含氧酸的酸性较强的是HNO3,过量的G与C的最高价含氧酸稀溶液反应的离子方程式为3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O.
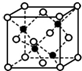
(5)E和G形成的某种晶胞如图所示:其中白球表示E,黑球表示G.则该物质的化学式为FeS,假设该晶胞的密度为ρ g/cm3,用NA表示阿伏加德罗常数,则该晶胞中距离最近的G原子之间的距离为$\frac{\sqrt{2}}{2}$×$\root{3}{\frac{352}{{N}_{A}ρ}}$cm.
分析 根据“A元素的质子数和质量数相等”推知A为H(氢);根据“B元素具有三个能级且所排电子数相同”推知B为C(碳);根据“D元素2p能级上电子数是2s能级的两倍”推知D为O(氧);根据“B、C、D原子序数依次增大”推知C为N(氮);根据“D和E相邻且同主族”推知E为S(硫);第四周期中Cr元素的未成对电子高达6个最多,故F为Cr(铬);根据“G是目前使用量最多的金属”推知G为Fe(铁).
(1)Cr的价电子排布式是保证3d能级和4s能级都处于半充满状态,更加稳定;
第一电离能同一周期从左到右呈增大趋势,ⅡA族、Ⅴ族反常;电负性同一主族自上而下逐渐降低;
(2)计算CO32-中碳原子孤电子对数、价层电子对数,确定碳原子杂化方式、微粒的空间构型,进而确定键角;
(3)铵盐属于离子化合物存在离子键也存在共价键;HCN分子中存在两条σ键和2条π键;NH3通过氢键形成“缔合”分子;
(4)非羟基氧数目越多,酸性越强;过量Fe与稀硝酸反应,Fe被氧化成+2价铁,稀硝酸被还原成NO,用H+保证电荷守恒,用H2O保证H和O的守恒;
(5)根据均摊法计算晶胞中Fe、S原子数目,约成最简整数比既得化学式;计算晶胞质量,根据密度×体积=质量的公式,假设该晶胞的边长为a,代入数据得a,二者距离最近的S原子之间距离为晶胞边长的$\frac{\sqrt{2}}{2}$.
解答 解:根据“A元素的质子数和质量数相等”推知A为H(氢);根据“B元素具有三个能级且所排电子数相同”推知B为C(碳);根据“D元素2p能级上电子数是2s能级的两倍”推知D为O(氧);根据“B、C、D原子序数依次增大”推知C为N(氮);根据“D和E相邻且同主族”推知E为S(硫);第四周期中Cr元素的未成对电子高达6个最多,故F为Cr(铬);根据“G是目前使用量最多的金属”推知G为Fe(铁).
(1)Cr的价电子排布式是保证3d能级和4s能级都处于半充满状态,更加稳定,故Cr的价电子排布为3d54s1;
第一电离能同一周期从左到右呈增大趋势,ⅡA族、Ⅴ族反常,故的原动力N>O>C;
电负性同一主族自上而下逐渐降低,故电负性O>S,
故答案为:3d54s1;N>O>C;O>S;
(2)CO32-中C原子孤电子对数=$\frac{4+2-2×3}{2}$=0,价层电子对数=3+0=3,故碳原子杂化方式为sp2杂化,空间构型为平面正三角形,键角为120°,
故答案为:sp2;平面正三角形;120°;
(3)铵盐属于离子化合物存在离子键也存在共价键,三种元素形成的铵盐可以是NH4NO3或者NH4NO2;
HCN中存在两条σ键和2条π键,二者之比为1:1;
NH3通过氢键形成“缔合”分子,导致相对分子质量增大,分子间作用力增强,分子间距离减小,导致密度反常增大,
故答案为:NH4NO3;1:1;NH3通过氢键形成“缔合”分子,导致相对分子质量增大,分子间作用力增强,分子间距离减小,导致密度反常增大;
(4)HNO3含有两个非羟基O,H2CO3存在一个非羟基O,故HNO3酸性更强.过量Fe与稀硝酸反应,Fe被氧化成+2价铁,稀硝酸被还原成NO,反应离子方程式为:3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O,
故答案为:HNO3;3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O;
(5)黑球铁处于晶胞晶胞,晶胞中含有4个Fe原子,白球S处于顶点和面心,晶胞中含有S原子数目为6×$\frac{1}{2}$+8×$\frac{1}{8}$=4,约成最简整数比既得化学式为FeS,
晶胞质量为4×$\frac{56+32}{{N}_{A}}$g,假设该晶胞的边长为a cm,则(a cm)3×ρ g/cm3=4×$\frac{56+32}{{N}_{A}}$g,则a=$\root{3}{\frac{352}{{N}_{A}ρ}}$,距离最近的S原子之间距离为晶胞边长的$\frac{\sqrt{2}}{2}$,故S原子之间距离为$\frac{\sqrt{2}}{2}$×$\root{3}{\frac{352}{{N}_{A}ρ}}$cm,
故答案为:FeS;$\frac{\sqrt{2}}{2}$×$\root{3}{\frac{352}{{N}_{A}ρ}}$.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、电离能、电负性、分子结构与性质、氢键、晶胞计算等,是对物质结构主干知识的综合考查,注意同周期第一电离能异常情况,(5)中计算为易错点、难点,需要学生具备一定的数学计算能力.

 备战中考寒假系列答案
备战中考寒假系列答案| A. | 被玻璃割伤手后,先取出伤口里的玻璃片,再用稀过氧化氢溶液擦洗,然后敷药包扎 | |
| B. | 制取蒸馏水时,为了防止瓶内产生暴沸现象,应向烧瓶内加入几片碎瓷片 | |
| C. | 温度计摔坏导致水银散落到地面上,应立即用水冲洗水银 | |
| D. | 滴瓶中的滴管用后不用清洗,直接放到原滴瓶中 |
| A. | 常温下干燥氯气与铁不反应,可以用钢瓶储存氯水 | |
| B. | 二氧化硫具有漂白、杀菌性能,可在食品生产中大量使用 | |
| C. | 浓硫酸具有吸水性,可以用来干燥氨气 | |
| D. | 次氯酸钠具有强氧化性,可用于配制消毒液 |
| A. | 原混合物中铜和铁各0.15mol | |
| B. | 第一次剩余9.6g金属为铜和铁 | |
| C. | 稀硝酸的物质的量浓度为2.0mol/L | |
| D. | 向反应后的溶液中再加入该硝酸200mL,又得到标准状况下的NO体积小于2.24L |
①Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H=-25kJ•mol-1
②3Fe2O3(s)+CO(g)═2Fe3O4(s)+CO2(g)△H=-47kJ•mol-1
③Fe3O4(s)+CO(g)═3FeO(s)+CO2(g)△H=19kJ•mol-1.
则FeO(s)被CO(g)还原成Fe(s)和CO2(g)的热化学方程式为( )
| A. | FeO+CO═Fe+CO2 △H=-11kJ•mol-1 | |
| B. | FeO(s)+CO(g)═Fe(s)+CO2(g)△H=-22kJ•mol-1 | |
| C. | FeO(s)+CO(g)═Fe(s)+CO2(g)△H=-11kJ•mol-1 | |
| D. | FeO(s)+CO(g)═Fe(s)+CO2(g))△H=11kJ•mol-1 |
| A. | 3p2表示3p能级有两个轨道 | |
| B. | 1s22s12p1表示的是激发态原子的电子排布 | |
| C. | M能层中的原子轨道数目为3 | |
| D. | 处于同一轨道上的电子可以有多个,它的运动状态完全相同 |
| A. |  用如图装置制备纯净的乙酸乙酯 | |
| B. |  用如图装置制备Fe(OH)2,并能保持一段时间的白色 | |
| C. |  用如图装置先通CO2、在通NH3制备Na2CO3 | |
| D. |  用如图装置制取少量NH3 |