题目内容
16.将22.4g铜与100mL一定浓度的硝酸反应,铜完全溶解,产生的NO和NO2混合气体在标准状况下的体积为6.72L,请回答:(1)NO和NO2的体积各为多少?
(2)将盛有所得上述混合气体的容器倒扣在水中,通入标准状况下一定体积的O2恰好使气体完全溶于水中,则通入的O2的体积是多少?
分析 (1)设NO和NO2的体积分别为x L与yL,则x+y=22.4
由电子得失守恒:($\frac{x}{22.4}$)×3+($\frac{y}{22.4}$)×1=($\frac{22.4}{64}$)×2
据此计算两种气体体积;
(2)生成的氮氧化物又和氧气反应生成硝酸,整个反应过程中Cu失去电子的物质的量等于氧气得到电子的物质的量,据此计算氧气体积.
解答 解:(1)设NO和NO2的体积分别为x L与yL,则x+y=22.4
由电子得失守恒:($\frac{x}{22.4}$)×3+($\frac{y}{22.4}$)×1=($\frac{22.4}{64}$)×2
解得x=4.48、y=2.24,
答:NO和NO2的体积分别为4.48L、2.24L;
(2)生成的氮氧化物又和氧气反应生成硝酸,整个反应过程中Cu失去电子的物质的量等于氧气得到电子的物质的量,设氧气体积为VL,
根据转移电子守恒得n(Cu)×2=$\frac{V}{22.4}$×4
即$\frac{22.4}{64}×2=\frac{V}{22.4}×4$
V=3.92,
答:消耗氧气体积在标况下是3.92L.
点评 本题考查氧化还原反应计算,为高频考点,明确各个物理量之间的关系式是解本题关键,侧重考查学生分析计算及知识的灵活运用,注意转移电子守恒的正确运用,题目难度中等.

练习册系列答案
相关题目
13.下列反应的化学方程式正确的是( )
| A. | 乙烯和溴单质反应:CH2═CH2+Br2→CH2-CH2Br2 | |
| B. | 合成聚乙烯塑料:nCH2═CH2→ | |
| C. | 皂化反应: +3H2O$→_{△}^{H+}$ +3H2O$→_{△}^{H+}$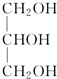 +3C17H35COOH +3C17H35COOH | |
| D. | 乙醇与金属钠反应:2CH3CH2OH+2Na→2CH3CH2ONa+H2↑ |
7. 如表是部分短周期元素的原子半径及常见化合价如表:
如表是部分短周期元素的原子半径及常见化合价如表:
(1)E元素在元素周期表的位置是第三周期VIA族,C为氯(填元素名称).
(2)B的最高价氧化物与硝酸反应的离子方程式为Al2O3+6H+=2Al3++3H2O
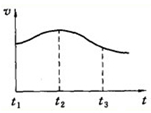
(3)某学生做A与盐酸反应的实验,去除表面的氧化镁等杂质,反应过程中感觉试管外壁发烫,试说明原因镁与盐酸的反应是放热反应,1gA完全反应放出热量为QKJ,则该反应的热化学方程式为Mg(s)+2HCl(aq)=MgCl2(aq)+H2(g)△H1=-24QKJ•mol-1该学生通过实验测得A与盐酸反应产生气体的速率(v):与时间(t)的关系如图所示,则t1~t2时间内反应速率逐渐加快的主要原因:镁与盐酸反应放热,温度升高反应速率加快.
 如表是部分短周期元素的原子半径及常见化合价如表:
如表是部分短周期元素的原子半径及常见化合价如表:| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.160 | 0.143 | 0.099 | 0.074 | 0.102 |
| 常见化合价 | +2 | +3 | -1 | -2 | +6,-2 |
(2)B的最高价氧化物与硝酸反应的离子方程式为Al2O3+6H+=2Al3++3H2O
(3)某学生做A与盐酸反应的实验,去除表面的氧化镁等杂质,反应过程中感觉试管外壁发烫,试说明原因镁与盐酸的反应是放热反应,1gA完全反应放出热量为QKJ,则该反应的热化学方程式为Mg(s)+2HCl(aq)=MgCl2(aq)+H2(g)△H1=-24QKJ•mol-1该学生通过实验测得A与盐酸反应产生气体的速率(v):与时间(t)的关系如图所示,则t1~t2时间内反应速率逐渐加快的主要原因:镁与盐酸反应放热,温度升高反应速率加快.
8.化学能与热能、电能等可以相互转化,关于化学能与其它能量相互转化的说法正确的是( )

| A. | 图I所示的装置能将化学能转变为电能 | |
| B. | 图II所示的反应为吸热反应 | |
| C. | 中和反应中,反应物的总能量比生成物的总能量低 | |
| D. | 化学反应中能量变化的主要原因是化学键的断裂与生成 |
5.下列各组中的两种物质作用时,反应条件或反应物的用量改变时,对生成物没有影响的是( )
| A. | Na与O2 | B. | NaOH与CO2 | C. | Ca(OH)2与NaHCO3 | D. | Na2O2 与CO2 |
6.从下列元素中:H、O、N、Si、S、Mg选出其中的一种或几种,组成典型的四类晶体,要求:每种元素只能出现一次;所填物质必须能够回答问题(2)和(3):
(1)填充下表:
(2)构成晶体B的基态原子的电子排布式为1s22s22p63s23p2,
D中原子采取的堆积方式为A3最密堆积.
(3)将晶体A溶于水,在所得的溶液中加入足量的盐酸,写出该反应的离子方程式2H++S2-=H2S↑.
(1)填充下表:
| 物质代号 | A | B | C | D |
| 晶体类型 | 离子晶体 | 原子晶体 | 分子晶体 | 金属晶体 |
| 相应的化学式 |
D中原子采取的堆积方式为A3最密堆积.
(3)将晶体A溶于水,在所得的溶液中加入足量的盐酸,写出该反应的离子方程式2H++S2-=H2S↑.
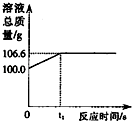 将一定量的CO2通入100g氢氧化钠溶液中恰好完全吸收,形成不饱和溶液,该溶液总质量与反应时间的变化关系如图.试分析解答:
将一定量的CO2通入100g氢氧化钠溶液中恰好完全吸收,形成不饱和溶液,该溶液总质量与反应时间的变化关系如图.试分析解答: