题目内容
6.用9mol/L的浓硫酸稀释成0.9mol/L的稀硫酸100mL,回答下列问题:(1)需要取浓硫酸10.0 mL
(2)在容量瓶的使用方法中下列操作正确的是A(填字母)
A.使用容量瓶前检查它是否漏水
B.配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加入蒸馏水到接近容量瓶刻度线1---2cm 时用胶头滴管滴加蒸馏水到刻度线
C.配制溶液时,如果试样是液体用量筒量取试样后直接倒入容量瓶中缓慢加入蒸馏水到接近容量瓶刻度线1---2cm 时用胶头滴管滴加蒸馏水到刻度线
(3)配制操作可分解成如下几步,以下正确的操作顺序是ADECBHGF
A.向容量瓶中注入少量蒸馏水,检查是否漏水
B.用少量蒸馏水洗涤烧杯及玻璃棒,将溶液注入容量瓶,并重复操作两次
C.用已冷却的稀硫酸注入已检查不漏水的容量瓶中
a
D.根据计算,用量筒量取一定体积的浓硫酸
E.将浓硫酸沿烧杯壁慢慢注入盛有蒸馏水的小烧杯中,并不断用玻璃棒搅拌
F.盖上容量瓶塞子,振荡,摇匀
G.用胶头滴管滴加蒸馏水,使溶液凹面恰好与刻度相切
H.继续往容量瓶中小心地加蒸馏水,使液面接近刻度线1-2cm.
分析 (1)根据溶液稀释前后物质的量不变计算所需浓硫酸的体积:
(2)容量瓶使用过程中需要上下颠倒,为防止漏水,使用前应检查是否漏水;容量瓶为配制一定物质的量浓度、特定体积溶液的专用仪器,不能用来溶解固体、稀释浓溶液;
(3)依据用浓溶液配制一定物质的量浓度稀溶液的一般操作步骤排序.
解答 解:(1)根据稀释定律,稀释前后溶质的物质的量不变,来计算浓硫酸的体积,设浓硫酸的体积为xmL,所以xmL×9mol/L=100mL×0.9mol/L,解得:x≈10.0.
所需浓硫酸的体积为10.0mL.
故答案为:10.0.
(2)A.容量瓶使用过程中需要上下颠倒,为防止漏水,使用前应检查是否漏水,故A正确;
B.容量瓶不能用来溶解固体,故B错误;
C.容量瓶不能用来稀释浓溶液,故C错误;
故选:A;
(3)用浓溶液配制一定物质的量浓度稀溶液的一般操作步骤:计算、量取、稀释、冷却、移液、洗涤、定容、摇匀、装瓶等,所以正确的操作顺序为:ADECBHGF;
故答案为:ADECBHGF.
点评 本题考查了一定物质的量浓度溶液的配制,明确配制原理及操作步骤是解题关键,注意容量瓶构造及使用方法和注意事项,题目难度不大.

练习册系列答案
相关题目
11.把VL含有硫酸镁和硫酸铝的混合溶液分成两等份,一份加入含有amol氢氧化钠溶液,恰好使铝离子完全转化为偏铝酸根离子(1mol铝离子消耗4摩尔氢氧化钠生成1摩尔偏铝酸根离子);另一份加入含有bmol氯化钡溶液,恰好使硫酸根离子完全沉淀为硫酸钡.则原混合溶液中镁离子的浓度为( )
| A. | $\frac{8b-3a}{2v}$mol/L | B. | $\frac{8b-3a}{4v}$mol/L | C. | $\frac{8b-3a}{v}$mol/L | D. | $\frac{a-2b}{2v}$mol/L |
18.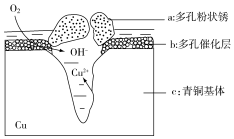 青铜器的制造是中华民族劳动人民智慧的结晶,成为一个时代的象征,但出土的青铜器大多受到环境腐蚀.如图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图.环境中的 Cl- 扩散到孔口,并与各电极产物作用生成多孔粉状锈 Cu2(OH)3Cl.下列说法不正确的是( )
青铜器的制造是中华民族劳动人民智慧的结晶,成为一个时代的象征,但出土的青铜器大多受到环境腐蚀.如图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图.环境中的 Cl- 扩散到孔口,并与各电极产物作用生成多孔粉状锈 Cu2(OH)3Cl.下列说法不正确的是( )
 青铜器的制造是中华民族劳动人民智慧的结晶,成为一个时代的象征,但出土的青铜器大多受到环境腐蚀.如图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图.环境中的 Cl- 扩散到孔口,并与各电极产物作用生成多孔粉状锈 Cu2(OH)3Cl.下列说法不正确的是( )
青铜器的制造是中华民族劳动人民智慧的结晶,成为一个时代的象征,但出土的青铜器大多受到环境腐蚀.如图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图.环境中的 Cl- 扩散到孔口,并与各电极产物作用生成多孔粉状锈 Cu2(OH)3Cl.下列说法不正确的是( )| A. | 腐蚀过程中,负极c被氧化 | |
| B. | 环境中的Cl-扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈Cu2(OH)3Cl,其离子方程式为2Cu2++3OH-+Cl-═Cu2(OH)3Cl↓ | |
| C. | 若生成 2.145 g Cu2(OH)3Cl,则理论上消耗标准状况氧气体积为 0.448 L | |
| D. | 正极的电极反应式为:O2+4e-+2H2O═4OH- |
16.下列变化需克服相同类型作用力的是( )
| A. | 碘和干冰的升华 | B. | 硅和C60的熔化 | ||
| C. | 氯化氢和氯化钠的溶解 | D. | 液溴和液汞的汽化 |
 氨基乙酸铜分子结构如图,碳原子的杂化方式为sp3、sp2,基态碳原子核外电子有6个空间运动状态.
氨基乙酸铜分子结构如图,碳原子的杂化方式为sp3、sp2,基态碳原子核外电子有6个空间运动状态.