题目内容
2.配平下列氧化还原反应方程式:2KMnO4+5H2S+3H2SO4(稀)═2MnSO4+5S↓+1K2SO4+8H2O.
分析 氧化还原反应中,元素化合价升高值等于元素化合价降低值,根据电子守恒来配平方程式.
解答 解:该反应中元素的化合价变化如下:H2S→S,S元素的化合价由-2价→0价,一个S失去2个电子; KMnO4→MnSO4,Mn元素的化合价由+7价→+2价,得到5e-,高锰酸钾中锰元素化合价降低7-2=5价,硫元素化合价升高0-(-2)=2价,化合价升高数=化合价降低数,所以得失电子的最小公倍数为10,所以高锰酸钾前的系数是2,H2S前的系数是5,根据原子守恒,S前是5,硫酸锰前是2,硫酸钾前面是1,根据硫酸根守恒,所以硫酸前面是3,据氧原子和氢原子守恒,产物有8个水分子,所以该反应为:2KMnO4+5H2S+3H2SO4=2MnSO4+5S↓+K2SO4+8H2O;
故答案为:2、5、3、2、5、1、8.
点评 本题考查氧化还原反应的配平,题目难度中等,根据电子守恒来配平方程式即可.

练习册系列答案
 金博士一点全通系列答案
金博士一点全通系列答案
相关题目
12.在水中加入等物质的量的Na+、Ag+、Pb2+和SO42-、Cl-、NO3-,然后放入惰性材料做电极的电解槽中,通电片刻,则氧化产物与还原产物的质量比为 ( )
| A. | 35.5:108 | B. | 16:207 | C. | 8:1 | D. | 108:35.5 |
17.在下列环境中能大量共存的离子组是( )
| A. | 弱碱性溶液中 Na+、K+、Cl-、HCO3- | B. | 酸性溶液中 Na+、ClO-、SO42-、I- | ||
| C. | 无色溶液中 Al3+、NH4+、Cl-、OH- | D. | 无色溶液中 Fe3+、K+、Cl-、SCN- |
7.下列说法正确的是( )
| A. | 按系统命名法,有机物  可命名为3,7-二甲基-4-乙基辛烷 可命名为3,7-二甲基-4-乙基辛烷 | |
| B. | 1 mol  最多能与含3 mol NaOH的水溶液完全反应 最多能与含3 mol NaOH的水溶液完全反应 | |
| C. | 纤维素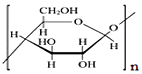 和壳聚糖 和壳聚糖 均属于多糖 均属于多糖 | |
| D. | 在一定条件下,1 mol的  最多能与含3 mol NaOH的溶液完全反应 最多能与含3 mol NaOH的溶液完全反应 |
14.下列有关食品添加剂的说法中,正确的是( )
| A. | 胭脂红是一种常见的疏松剂 | |
| B. | 碳酸氢钠具有碱性,是一种常见的调味剂 | |
| C. | 山梨酸钾是一种常见的防腐剂 | |
| D. | 胡萝卜素是一种人工食用色素 |
11.下列各组物质全部是弱电解质的是( )
| A. | H2O、NH3•H2O、H3PO4、HF | B. | Cu(OH)2、CH3COOH、C2H5OH、CH3COONa | ||
| C. | H2SO3、Ba(OH)2、BaSO4 | D. | SO2、H2S、CO2 |
