题目内容
10.下列反应属于离子反应的是( )| A. | 氢气和氧气反应生成水 | B. | 氧化铁投入稀盐酸中 | ||
| C. | 高锰酸钾加热分解生成氧气 | D. | 钠在空气中燃烧 |
分析 有离子参加的反应属于离子反应,一般在溶液中进行,以此解答该题.
解答 解:A.氢气与氧气的反应,不是溶液中的反应,不属于离子反应,故A错误;
B.氧化铁投入稀盐酸中,氧化铁与氢离子反应,属于离子反应,故B正确;
C.为固体的分解,不在溶液中进行,不是离子反应,故C错误;
D.钠在空气中燃烧生成过氧化钠,不是离子反应,故D错误.
故选B.
点评 本题考查离子反应,侧重于学生的分析能力的考查,为高考高频考点,注意把握反应的特点和离子反应的条件,难度不大.

练习册系列答案
 初中学业考试导与练系列答案
初中学业考试导与练系列答案
相关题目
20.下列叙述正确的是( )
| A. | 1 mol H3PO4的质量为98g.mol-1 | B. | H3PO4的摩尔质量为98 g | ||
| C. | 9.8 g H3PO4含有NA个H3PO4分子? | D. | NA个H3PO4分子的质量为98g |
1.某同学完成如下探究实验:
实验目的:比较Cl2、Br2、I2三种单质的氧化性强弱
实验药品:NaBr溶液、KI溶液、氯水、淀粉溶液
实验记录:
反思与评价:
(1)步骤①反应的离子方程式为:2Br-+Cl2=Br2+2Cl-.
(2)检验②中所得黄色溶液含I2的另一种方法是(简述实验操作和相应的实验现象)
向溶液中加入CCl4,振荡,静置,液体分为上下两层,下层呈紫红色.
(3)你认为上述实验设计(填“能”或“不能”)不能达到实验目的,理由是①中所得黄色溶液中可能含有Cl2,会干扰Br2、I2氧化性的比较.
实验目的:比较Cl2、Br2、I2三种单质的氧化性强弱
实验药品:NaBr溶液、KI溶液、氯水、淀粉溶液
实验记录:
| 实验步骤 | 实验现象 | 实验结论 |
 | 溶液变为黄色 | 氧化性:Cl2>Br2 |
 | 溶液变为黄色 | 氧化性: Br2>I2 |
 | 溶液的颜色由黄色变为蓝色 |
(1)步骤①反应的离子方程式为:2Br-+Cl2=Br2+2Cl-.
(2)检验②中所得黄色溶液含I2的另一种方法是(简述实验操作和相应的实验现象)
向溶液中加入CCl4,振荡,静置,液体分为上下两层,下层呈紫红色.
(3)你认为上述实验设计(填“能”或“不能”)不能达到实验目的,理由是①中所得黄色溶液中可能含有Cl2,会干扰Br2、I2氧化性的比较.
18.电化学降解NO3-可治理硝酸盐的污染,原理如图所示.下列说法中不正确的是( )


| A. | 通电时阴极附近溶液的酸性增强 | |
| B. | 铅蓄电池的A极为正极 | |
| C. | 通电时,H+由左至右通过质子交换膜 | |
| D. | 通电时,Pt电极的质量几乎不变 |
15.下列电离方程式正确的是( )
| A. | NaHCO3═Na++H++CO32- | B. | H2SO4═2H++SO42- | ||
| C. | FeCl3═Fe3++Cl3- | D. | Ba(OH)2═Ba2++2OH- |
2.T3℃时,将A、B、C三种物质分别溶于100克水中,制成饱和溶液.这三种物质的溶解度随温度而变化的曲线如图.从T3降至T1,下列有关说法正确的是( )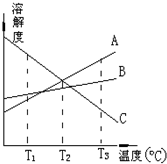

| A. | T3℃时,由A物质所形成的溶液的物质的量浓度最大 | |
| B. | T2℃时,由A、C两物质形成的溶液质量分数相等 | |
| C. | T1℃时,由B物质所形成的溶液质量分数最大,C的最小 | |
| D. | 从溶解度曲线可知分离A、C的混合溶液得到A可采用蒸发结晶 |
19.0.5LFeCl3溶液中Cl-为9.03×1023个,则FeCl3溶液的物质的量浓度为( )
| A. | 0.1mol•L-1 | B. | 1mol•L-1 | C. | 3mol•L-1 | D. | 1.5mol•L-1 |
12.保护环境已成为人类的共识,人类应以可持续发展的方式使用资源,以合理的方式对废物进行处理并循环使用.下列做法不利于环境保护的是( )
| A. | 发电厂的煤经脱硫处理 | B. | 将煤转化为水煤气作燃料 | ||
| C. | 不使用塑料袋及一次性泡沫餐盒 | D. | 硫酸厂的废液经中和后直接排放 |
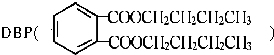 是一种常见的塑化剂,
是一种常见的塑化剂,
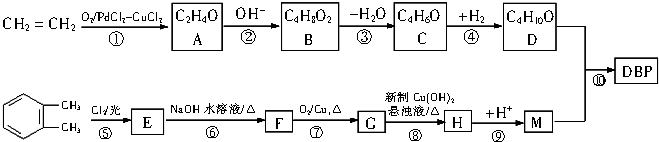
 .
. .
.
 .
.