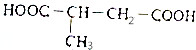题目内容
19.0.5LFeCl3溶液中Cl-为9.03×1023个,则FeCl3溶液的物质的量浓度为( )| A. | 0.1mol•L-1 | B. | 1mol•L-1 | C. | 3mol•L-1 | D. | 1.5mol•L-1 |
分析 先根据n=$\frac{N}{{N}_{A}}$计算出溶液中氯离子的物质的量,然后根据氯化铁的化学式组成计算出氯化铁的物质的量,最后根据c=$\frac{n}{V}$计算出FeCl3溶液的物质的量浓度.
解答 解:9.03×1023个Cl-的物质的量为:n(Cl-)═$\frac{9.03×1{0}^{23}}{6.02×1{0}^{23}}$=1.5mol,
该溶液中FeCl3的物质的量为:n(FeCl3)=$\frac{1}{3}$n(Cl-)=1.5mol×$\frac{1}{3}$=0.5mol
该FeCl3溶液的物质的量浓度为:c(FeCl3)=$\frac{0.5mol}{0.5L}$=1mol/L,
故选B.
点评 本题考查了物质的量浓度的计算,题目难度不大,明确物质的量浓度的概念及表达式为解答关键,注意掌握物质的量与物质的量浓度、阿伏伽德罗常数之间的关系,试题培养了学生的化学计算能力.

练习册系列答案
相关题目
10.下列反应属于离子反应的是( )
| A. | 氢气和氧气反应生成水 | B. | 氧化铁投入稀盐酸中 | ||
| C. | 高锰酸钾加热分解生成氧气 | D. | 钠在空气中燃烧 |
7.下列说法正确的是( )
| A. | 按系统命名法,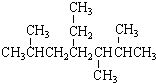 的名称为2,5,6-三甲基-4-乙基庚烷 的名称为2,5,6-三甲基-4-乙基庚烷 | |
| B. | 常压下,正戊烷、异戊烷、新戊烷的沸点依次增大 | |
| C. | 相同质量的烃,完全燃烧,消耗O2越多,烃中含ω(H)越高 | |
| D. | 乙烯和甲烷可用溴的四氯化碳溶液鉴别 |
14.少量铁粉与100mL 0.01mol/L的稀盐酸反应,反应速率太慢.为了加快此反应速率而不改变H2的产量,以下方法中可行的是( )
①加H2O ②加NaOH固体 ③滴入几滴浓盐酸 ④加CH3COONa固体 ⑤加NaCl溶液 ⑥滴加几滴硫酸铜溶液
⑦从常温升高到30℃(不考虑盐酸挥发) ⑧改用10mL 0.1mol/L的盐酸.
①加H2O ②加NaOH固体 ③滴入几滴浓盐酸 ④加CH3COONa固体 ⑤加NaCl溶液 ⑥滴加几滴硫酸铜溶液
⑦从常温升高到30℃(不考虑盐酸挥发) ⑧改用10mL 0.1mol/L的盐酸.
| A. | ①⑥⑦ | B. | ③⑤⑧ | C. | ③⑦⑧ | D. | ⑤⑥⑧ |
20.下列描述正确的是( )
| A. | 氨水上的标签应标注 | B. | 乙烯的结构简式:CH2CH2 | ||
| C. | O2-的结构示意图: | D. | BeCl2的电子式: |
1.化学与生活密切相关,下列有关说法不正确的是( )
| A. | 淀粉、蛋白质、脂肪都属于营养物质 | |
| B. | 误食重金属盐,可立即喝牛奶或生蛋清进行解毒 | |
| C. | 棉线和毛线的主要成分都是纤维素 | |
| D. | 新居室内装饰材料中缓慢释放出的甲醛等有机物会污染室内空气 |