题目内容
5.室温下,下列各组离子在指定溶液中能大量共存的是( )| A. | (NH4)2Fe(SO4)2溶液中:Ba2+、K+、OH-、Br- | |
| B. | 通入过量SO2气体的溶液中:Fe3+、NO3-、Ba2+、H+ | |
| C. | $\frac{c(O{H}^{-})}{c({H}^{+})}$=10-12的溶液中:NH4+、Cu2+、NO3-、Cl- | |
| D. | c(I-)=0.1 mol•L-1的溶液中:Na+、Fe3+、ClO-、SO42- |
分析 A.离子之间结合生成沉淀、弱电解质等;
B.发生氧化还原反应;
C.$\frac{c(O{H}^{-})}{c({H}^{+})}$=10-12的溶液,显酸性;
D.离子之间发生氧化还原反应.
解答 解:A.Ba2+、SO42-结合生成沉淀,Fe2+、OH-结合生成沉淀,OH-、NH4+结合生成电解质等,不能大量共存,故A错误;
B.SO2、NO3-、H+发生氧化还原反应,生成的SO42-与Ba2+结合生成沉淀,不能大量共存,故B错误;
C.$\frac{c(O{H}^{-})}{c({H}^{+})}$=10-12的溶液,显酸性,该组离子之间不反应,可大量共存,故C正确;
D.Fe3+、ClO-分别与I-发生氧化还原反应,不能大量共存,故D错误;
故选C.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重复分解反应、氧化还原反应的离子共存考查,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
16.下列物质既不能与甲烷反应,也不能与乙烯反应的是( )
| A. | 氯气 | B. | 溴水 | ||
| C. | 二氧化碳 | D. | 酸性高锰酸钾溶液 |
13. 乙醇在一定的条件下发生化学反应时,化学键断裂的情况如图所示.当乙醇和氧气发生催化氧化时,化学键断裂的位置是 ( )
乙醇在一定的条件下发生化学反应时,化学键断裂的情况如图所示.当乙醇和氧气发生催化氧化时,化学键断裂的位置是 ( )
 乙醇在一定的条件下发生化学反应时,化学键断裂的情况如图所示.当乙醇和氧气发生催化氧化时,化学键断裂的位置是 ( )
乙醇在一定的条件下发生化学反应时,化学键断裂的情况如图所示.当乙醇和氧气发生催化氧化时,化学键断裂的位置是 ( )| A. | 2 3 | B. | 2 4 | C. | 1 3 | D. | 3 4 |
10.下列叙述正确的是( )
| A. | 将氯化铁饱和溶液逐滴滴入氢氧化钠稀溶液中,边滴边搅拌,可获得氢氧化铁胶体 | |
| B. | 不能用乙醇萃取碘水中的碘是因为碘在水中溶解度比在乙醇中大 | |
| C. | 实验室可通过蒸馏的方法除去自来水中含有的氯离子等杂质制蒸馏水 | |
| D. | 定容时俯视容量瓶的刻度线会导致所配制的溶液浓度偏低 |
17.太阳能是一种应用广泛的绿色能源.如图是太阳能电池经太阳光照射前和太阳光照射时内部电子的变化情况.图乙中灯泡变亮.关于该过程的描述正确的是( )


| A. | 该过程光能变为化学能再变为电能 | B. | 太阳能电池可以用高纯硅制造 | ||
| C. | N为电子流入的一极 | D. | 用该电池精炼铜时粗铜与N极连接 |
14.对4FeCl2+4Na2O2+6H2O=4Fe(OH)3↓+O2↑+8NaCl,下列说法错误的是( )
| A. | 用于氧化FeCl2的Na2O2占全部的Na2O2一半 | |
| B. | 氧气是氧化产物 | |
| C. | 氢氧化铁是氧化产物,氧气是还原产物 | |
| D. | 做氧化剂的过氧化钠和做还原剂的过氧化钠物质的量之比为3:1 |
15.下列有关物质性质或用途的说法正确的是( )
| A. | 医疗上,常用碳酸钠治疗胃酸过多 | |
| B. | 制水泥和玻璃都用到石灰石原料 | |
| C. | 氨液化放出大量的热,可用作制冷剂 | |
| D. | Si可用作太阳能电池和光导纤维的原料 |
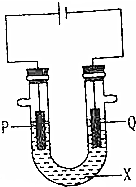 为探究工业生产氯气的原理,某同学设计了如图的实验装置,其中U型管中装有物质X,并乙滴入几滴酚酞试液,P,Q两根石墨棒作为电极,通过导线与直流电源相连.请回答以下问题.
为探究工业生产氯气的原理,某同学设计了如图的实验装置,其中U型管中装有物质X,并乙滴入几滴酚酞试液,P,Q两根石墨棒作为电极,通过导线与直流电源相连.请回答以下问题.