题目内容
14.对4FeCl2+4Na2O2+6H2O=4Fe(OH)3↓+O2↑+8NaCl,下列说法错误的是( )| A. | 用于氧化FeCl2的Na2O2占全部的Na2O2一半 | |
| B. | 氧气是氧化产物 | |
| C. | 氢氧化铁是氧化产物,氧气是还原产物 | |
| D. | 做氧化剂的过氧化钠和做还原剂的过氧化钠物质的量之比为3:1 |
分析 4FeCl2+4Na2O2+6H2O=4Fe(OH)3↓+O2↑+8NaCl中,Fe元素的化合价由+2价升高为+3价,过氧化钠中O元素的化合价由-1价降低为-2价,由-1价升高为0,以此来解答.
解答 解:4FeCl2+4Na2O2+6H2O=4Fe(OH)3↓+O2↑+8NaCl中,Fe元素的化合价由+2价升高为+3价,过氧化钠中O元素的化合价由-1价降低为-2价,由-1价升高为0,
A.由方程式可知4molNa2O2参加反应时,2molO失去电子,6molO得到电子,其中4molO用于氧化FeCl2,即2molNa2O2氧化FeCl2,则用于氧化FeCl2的Na2O2占全部的Na2O2一半,故A正确;
B.因O元素的化合价升高也降低,则氧气是氧化产物也是还原产物,故B错误;
C.因反应中,Fe元素的化合价升高,O元素的化合价降低,Fe(OH)3既是氧化产物又是还原产物,故C错误;
D.由O原子守恒可知,4molNa2O2参加反应时,2molO失去电子,6molO得到电子,则做氧化剂的过氧化钠和做还原剂的过氧化钠物质的量之比为3:1,故D正确.
故选BC.
点评 本题考查氧化还原反应,为高考常见题型,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念的考查,选项C为解答的难点,题目难度不大.

练习册系列答案
 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案
相关题目
4.下列反应需要加入还原剂才能实现的是( )
| A. | MnO4-→Mn2+ | B. | Cl-→Cl2 | C. | HCO3-→CO2 | D. | PCl5→H3PO4 |
5.室温下,下列各组离子在指定溶液中能大量共存的是( )
| A. | (NH4)2Fe(SO4)2溶液中:Ba2+、K+、OH-、Br- | |
| B. | 通入过量SO2气体的溶液中:Fe3+、NO3-、Ba2+、H+ | |
| C. | $\frac{c(O{H}^{-})}{c({H}^{+})}$=10-12的溶液中:NH4+、Cu2+、NO3-、Cl- | |
| D. | c(I-)=0.1 mol•L-1的溶液中:Na+、Fe3+、ClO-、SO42- |
9.等量的苛性钠溶液分别用pH值为2和3的醋酸溶液中和,设消耗醋酸溶液的体积依次为Va和Vb,则它们之间的关系是( )
| A. | Va>10Vb | B. | Vb=10Va | C. | Va<10Vb | D. | Vb>10Va |
4.下列有机物命名正确的是( )
| A. | 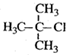 2-甲基-2-氯丙烷 | B. |  1,3,4-三甲苯 | C. | 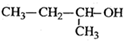 2-甲基-1-丙醇 | D. | 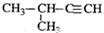 2-甲基-3-丁炔 |