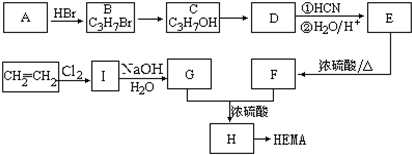
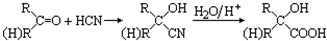
题目内容
1.亚硝酸的酸性强于次氯酸的原因为HNO2中非羟基氧的个数比HClO中非羟基氧的个数多,导致中心原子的正电性高,使羟基上的氢更容易电离.分析 比较含氧酸的酸性强弱,可根据非羟基氧的数目判断,一般来说,非羟基氧越多酸性越强,以此解答该题.
解答 解:HNO2中非羟基氧的个数为1,HClO中非羟基氧的个数为0,HNO2中非羟基氧的个数比HClO中非羟基氧的个数多,导致中心原子的正电性高,使羟基上的氢更容易电离,则亚硝酸的酸性较强.
故答案为:HNO2中非羟基氧的个数比HClO中非羟基氧的个数多,导致中心原子的正电性高,使羟基上的氢更容易电离.
点评 本题考查元素周期率知识,为高频考点,侧重于学生的分析能力的考查,本题为选修三内容,涉及含氧酸的酸性比较,注意把握问题比较的角度,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
11.下列事实中,不能用勒夏特列原理解释的是( )
| A. | 溴水中有下列平衡:Br2+H2O?HBr+HBrO当加入AgNO3(s)后溶液颜色变浅 | |
| B. | 2NO2(g)?N2O4(g)△H<0,升高温度可使体系颜色加深 | |
| C. | 反应N2+3H2?2NH3△H<0,增大压强可提高N2的转化率 | |
| D. | 合成氨反应CO+NO2?CO2+NO△H>0中使用催化剂 |
12.已知下列溶液的溶质都是强电解质,这些溶液中的Cl-浓度与50mL 1mol•L-1 MgCl2溶液的Cl-浓度相等的是( )
| A. | 150 mL 1 mol•L-1 NaCl溶液 | B. | 75 mL 2 mol•L-1CaCl2溶液 | ||
| C. | 150 mL 2 mol•L-1 KCl溶液 | D. | 75 mL 1 mol•L-1AlCl3溶液 |
9.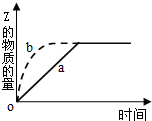 如图曲线a表示可逆反应X(g)+Y(g)?Z(g)+M(g).进行过程中Z的物质的量随时间变化的关系.若要改变起始条件,使反应过程按b曲线进行,可采取的措施是( )
如图曲线a表示可逆反应X(g)+Y(g)?Z(g)+M(g).进行过程中Z的物质的量随时间变化的关系.若要改变起始条件,使反应过程按b曲线进行,可采取的措施是( )
 如图曲线a表示可逆反应X(g)+Y(g)?Z(g)+M(g).进行过程中Z的物质的量随时间变化的关系.若要改变起始条件,使反应过程按b曲线进行,可采取的措施是( )
如图曲线a表示可逆反应X(g)+Y(g)?Z(g)+M(g).进行过程中Z的物质的量随时间变化的关系.若要改变起始条件,使反应过程按b曲线进行,可采取的措施是( )| A. | 压缩反应容器的体积 | B. | 加入一定量的Z | ||
| C. | 降低温度 | D. | 减少X的投入量 |
10.下列离子方程式书写正确的是( )
| A. | 金属钠投入水中:Na+H2O═Na++OH-+H2↑ | |
| B. | 足量铁加入少量稀硝酸中:Fe+4H++NO3-═Fe3++NO↑+2H2O | |
| C. | 向硫酸铝铵[NH4Al(SO4)2]溶液中滴加少量Ba(OH)2溶液NH4++Al3++2SO42-+2Ba2++5OH-=AlO2-+2BaSO4↓+NH3•H2O+2H2O | |
| D. | 用银氨溶液检验乙醛中的醛基:CH3CHO+2[Ag(NH3)2]++2OH-$\stackrel{水浴加热}{→}$CH3COO-+NH4++3NH3+2Ag↓+H2O |
11.25℃,两种酸的电离平衡常数如表.
①HSO3-的电离平衡常数表达式K=$\frac{c({H}^{+})•c(S{{O}_{3}}^{2-})}{c(HS{{O}_{3}}^{-})}$.
②0.10mol•L-1NaHSO3溶液中离子浓度由大到小的顺序为c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-).
③H2SO3溶液和NaHCO3溶液反应的主要离子方程式为H2SO3+2HCO3-=SO32-+2CO2↑+2H2O.
| Ka1 | Ka2 | |
| H2SO3 | 1.3×10-2 | 6.3×10-4 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
②0.10mol•L-1NaHSO3溶液中离子浓度由大到小的顺序为c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-).
③H2SO3溶液和NaHCO3溶液反应的主要离子方程式为H2SO3+2HCO3-=SO32-+2CO2↑+2H2O.
 图乙为一个金属铜的晶胞,请完成以下各题.
图乙为一个金属铜的晶胞,请完成以下各题.