题目内容
11.下列事实中,不能用勒夏特列原理解释的是( )| A. | 溴水中有下列平衡:Br2+H2O?HBr+HBrO当加入AgNO3(s)后溶液颜色变浅 | |
| B. | 2NO2(g)?N2O4(g)△H<0,升高温度可使体系颜色加深 | |
| C. | 反应N2+3H2?2NH3△H<0,增大压强可提高N2的转化率 | |
| D. | 合成氨反应CO+NO2?CO2+NO△H>0中使用催化剂 |
分析 勒夏特列原理为:如果改变影响平衡的条件之一,平衡将向着能够减弱这种改变的方向移动,使用勒夏特列原理时,该反应必须是可逆反应,否则勒夏特列原理不适用.
解答 解:A.加入NaOH溶液后,NaOH和HBr、HBrO发生中和反应导致平衡正向移动,则溶液颜色变浅,能用平衡移动原理解释,故A不选;
B.升高温度,平衡逆向移动,气体颜色变深,能用平衡移动原理解释,故B不选;
C.增大压强平衡正向移动导致氮气转化率增大,能用平衡移动原理解释,故C不选;
D.催化剂只能改变反应速率但不能改变平衡移动,所以不能用平衡移动原理解释,故D选;
故选D.
点评 本题考查化学平衡移动原理,为高频考点,明确化学平衡移动原理适用范围是解本题关键,只有改变条件时能引起平衡移动的才能用平衡移动原理解释,否则不能,题目难度不大.

练习册系列答案
相关题目
14.两种气态烃组成的混合气体0.1mol,完全燃烧得0.16mol CO2和3.6g H2O,下列说法正确的是( )
| A. | 一定有乙烷 | B. | 一定是甲烷和乙烯 | ||
| C. | 一定有甲烷 | D. | 一定有乙炔 |
2.短周期主族元素X、Y、Z、W的原子序数依次增大,且原子的最外层电子数之和为19.X的气态氢化物可与其最高价含氧酸反应生成离子化合物,Z+与Y2-具有相同的电子层结构.下列说法不正确的是( )
| A. | 工业上电解熔融的ZW制备Z单质 | |
| B. | 元素Y与Z形成的化合物中只能有一种化学键 | |
| C. | 离子半径大小顺序为W>X>Y>Z | |
| D. | 在一定条件下X的氢化物能与Y单质发生置换反应 |
16.下列化学式对应的结构式从成键情况看不合理的是( )
| A. | CH3N, | B. | CH2SeO, | C. | CH4S, | D. | CH4Si |
20.下列实验操作中正确的是( )
| A. | 蒸发操作时,将蒸发皿中固体完全蒸干后停止加热 | |
| B. | 过滤操作时,直接将过滤液慢慢向漏斗中倾倒 | |
| C. | 分液操作时,分液漏斗中的下层液体从下口放出,上层液体从上口倒出 | |
| D. | 蒸馏操作时,温度计下端应插入液面下 |
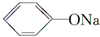 +CH3I→
+CH3I→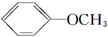 +NaI
+NaI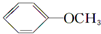 +HI→
+HI→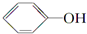 +CH3l
+CH3l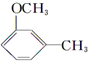 $\stackrel{KMnO_{4}(H+)}{→}$
$\stackrel{KMnO_{4}(H+)}{→}$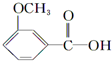
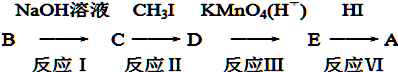
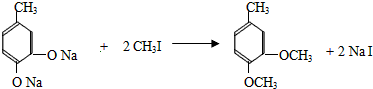 .
. .
.