题目内容
16.Na、Al、Fe是生活中常见的金属元素.(1)工业上以铝土矿(主要成分Al2O3•3H2O)为原料生产铝,主要包括下列过程
①将粉碎、筛选后的铝土矿溶解在氢氧化钠溶液中②通入过量二氧化碳使①所得溶液中析出氢氧化铝固体③使氢氧化铝脱水生成氧化铝④电解熔融氧化铝生成铝.写出②所涉及的离子方程式:AlO2-+2H2O+CO2═Al(OH)3↓+HCO3-,蒸干AlCl3溶液不能得到无水AlCl3,若使SOCl2与AlCl3•6H2O混合并加热,可得到无水AlCl3,用化学方程式解释:
6SOCl2+AlCl3•6H2O$\frac{\underline{\;\;△\;\;}}{\;}$12HCl+6SO2↑+AlCl3
(2)铁在地壳中的含量约占 5%左右.铁矿石的种类很多,重要的有磁铁矿石、赤铁矿石等.红热的铁能跟水蒸气反应,则其反应的化学方程式为3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2.其生成黑色的物质溶于酸后,加入KSCN,见不到血红色产生,其原因是Fe3O4+8H+═Fe2++2Fe3++4H2O、Fe+2Fe3+=3Fe2+(用离子方程式解释)工业炼铁常用赤铁矿与Al在高温下反应制备,写出方程式:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3.
(3)钠的化合物中,其中纯碱显碱性的原因:CO32-+H2O?HCO3-+OH-,(用方程式解释)向饱和的纯碱溶液中通入过量的二氧化碳有晶体析出,写出离子方程式CO2+H2O+2Na++CO32-=2NaHCO3↓.
分析 (1)偏铝酸钠可以和过量二氧化碳反应生成氢氧化铝沉淀和碳酸氢钠,根据离子方程式的书写方法来书写;使SOCl2与AlCl3•6H2O混合并加热,可得到无水AlCl3,说明反应产生了抑制铝离子水解的氯化氢,根据化合价不变写出反应方程式;
(2)红热的铁能与水蒸气发生反应,生成Fe3O4和一种可燃性气体,可燃气体为氢气;黑色的物质溶于酸后,加入KSCN,见不到血红色产生,说明溶液中无亚铁离子,可能是黑色固体物质中含有单质铁,或者溶于还原性的酸;铝热反应方程式为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3;
(3)钠的化合物中纯碱是强碱弱酸盐,碳酸钠水解而使溶液呈碱性;向饱和的纯碱溶于中通入过量的二氧化碳反应生成碳酸氢钠.
解答 解:(1)偏铝酸钠和过量二氧化碳反应生成氢氧化铝沉淀和碳酸氢钠,即AlO2-+2H2O+CO2═Al(OH)3↓+HCO3-;使SOCl2与AlCl3•6H2O混合并加热,可得到无水AlCl3,说明反应中产生了抑制铝离子水解的氯化氢,该反应中元素化合价不变,则生成、氯化铝、二氧化硫和氯化氢气体,所以SOCl2与AlCl3•6H2O混合加热发生反应的化学方程式:6SOCl2+AlCl3•6H2O$\frac{\underline{\;\;△\;\;}}{\;}$12HCl+6SO2↑+AlCl3,
故答案为:AlO2-+2H2O+CO2═Al(OH)3↓+HCO3-;6SOCl2+AlCl3•6H2O$\frac{\underline{\;\;△\;\;}}{\;}$12HCl+6SO2↑+AlCl3;
(2)红热的铁能与水蒸气发生反应,生成Fe3O4和氢气,反应为3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2,黑色的物质溶于酸后,加入KSCN,见不到血红色产生,说明溶液中无亚铁离子,可能是黑色固体物质中含有单质铁,或者溶于还原性的酸,反应方程式为:Fe3O4+8H+═Fe2++2Fe3++4H2O,Fe+2Fe3+=3Fe2+,或者Fe3O4+8H++2I-=3Fe2++4H2O+I2,铝热反应方程式为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3,
故答案为:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2;Fe3O4+8H+═Fe2++2Fe3++4H2O,Fe+2Fe3+=3Fe2+;2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3;
(3)纯碱是强碱弱酸盐,在纯碱溶液中CO32-易水解生成氢氧根离子:CO32-+H2O?HCO3-+OH-,导致溶液中氢氧根离子浓度大于氢离子浓度而使溶液呈碱性,反应生成碳酸氢钠,离子反应为CO2+H2O+2Na++CO32-=2NaHCO3↓,
故答案为:CO32-+H2O?HCO3-+OH-,CO2+H2O+2Na++CO32-=2NaHCO3↓.
点评 本题考查了盐的水解原理及其应用,注意掌握盐的水解原理及影响因素,铝热反应,氧化还原反应,题目难度中等.

| A. | 1 mol CH≡CH可以与Br2发生加成反应,消耗2 mol Br2 | |
| B. | 苯的邻位二元取代物只有一种可以说明苯分子不具有碳碳单键和碳碳双键的交替结构 | |
| C. | 2甲基戊烷的沸点高于己烷 | |
| D. | 用水可区分苯和溴苯 |
| A组 | B组 |
| Ⅰ.H-I键的键能大于H-Cl键的键能 Ⅱ.H-I键的键能小于H-Cl键的键能 Ⅲ.H-I键的键能小于H-Cl键的键能 Ⅳ.HI分子间作用力小于HCl分子间作用力 | ①HI比HCl稳定 ②HCl比HI稳定 ③HI沸点比HCl低 ④HI沸点比HCl低 |
| A. | Ⅰ① | B. | Ⅱ② | C. | Ⅲ③ | D. | Ⅳ④ |
| A. | 用CCl4鉴别溴水和碘水 | |
| B. | 用AgNO3溶液鉴别溴化钾溶液和氯化钠溶液 | |
| C. | 向某盐溶液中加入氢氧化钠溶液并加热,产生使湿润的红色石蕊试纸变蓝的气体,溶液中一定有NH4+ | |
| D. | 向某盐溶液中,加入盐酸,产生使澄清石灰水变浑浊的气体,溶液中含有大量CO32-离子 |
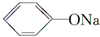 +CH3I→
+CH3I→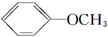 +NaI
+NaI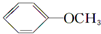 +HI→
+HI→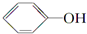 +CH3l
+CH3l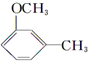 $\stackrel{KMnO_{4}(H+)}{→}$
$\stackrel{KMnO_{4}(H+)}{→}$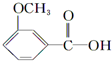
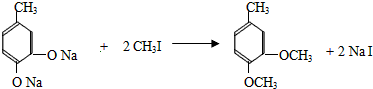 .
. .
.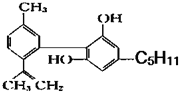 :回答下列问题:大麻酚的分子式为:C21H26O2,它与足量的溴水反应最多消耗Br23mol.
:回答下列问题:大麻酚的分子式为:C21H26O2,它与足量的溴水反应最多消耗Br23mol.