题目内容
9.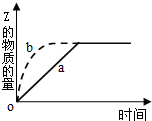 如图曲线a表示可逆反应X(g)+Y(g)?Z(g)+M(g).进行过程中Z的物质的量随时间变化的关系.若要改变起始条件,使反应过程按b曲线进行,可采取的措施是( )
如图曲线a表示可逆反应X(g)+Y(g)?Z(g)+M(g).进行过程中Z的物质的量随时间变化的关系.若要改变起始条件,使反应过程按b曲线进行,可采取的措施是( )| A. | 压缩反应容器的体积 | B. | 加入一定量的Z | ||
| C. | 降低温度 | D. | 减少X的投入量 |
分析 由图象可知,由曲线a到曲线b,到达平衡的时间缩短,改变条件,反应速率加快,且平衡时Z的物质的量不变,说明条件改变不影响平衡状态的移动,据此结合选项判断.
解答 解:由图象可知,由曲线a到曲线b,到达平衡的时间缩短,改变条件,反应速率加快,且平衡时Z的物质的量不变,说明条件改变不影响平衡状态的移动,
A.压缩容器体积,增大了压强,反应速率加快,由于该反应是气体体积不变的反应,则达到平衡时Z的物质的量不变,该变化与图象曲线变化一致,故A正确;
B.加入一定量的Z,平衡时Z的物质的量会偏大,故B错误;
C.该反应正反应是放热反应,降低温度,反应速率减慢,平衡向正反应移动,Z的物质的量减小,故C错误;
D.减少X的投入量,反应物浓度减小,反应速率会减小,故D错误;
故选A.
点评 本题考查了化学平衡、化学反应速率的影响及其应用,题目难度中等,明确影响化学反应速率、化学平衡的元素为解答关键,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
20.下列实验操作中正确的是( )
| A. | 蒸发操作时,将蒸发皿中固体完全蒸干后停止加热 | |
| B. | 过滤操作时,直接将过滤液慢慢向漏斗中倾倒 | |
| C. | 分液操作时,分液漏斗中的下层液体从下口放出,上层液体从上口倒出 | |
| D. | 蒸馏操作时,温度计下端应插入液面下 |
4.下列说法中不 正确的是( )
| A. | 1 mol CH≡CH可以与Br2发生加成反应,消耗2 mol Br2 | |
| B. | 苯的邻位二元取代物只有一种可以说明苯分子不具有碳碳单键和碳碳双键的交替结构 | |
| C. | 2甲基戊烷的沸点高于己烷 | |
| D. | 用水可区分苯和溴苯 |
14.在下列反应中,反应物中每个原子都参加氧化还原反应的是( )
| A. | 2KNO3+3C+S$\frac{\underline{\;\;△\;\;}}{\;}$K2S+N2↑+3CO2↑ | B. | 2NaCl $\frac{\underline{\;电解\;}}{\;}$2Na+Cl2↑ | ||
| C. | 2AgNO3$\frac{\underline{\;\;△\;\;}}{\;}$2Ag+2NO2↑+O2↑ | D. | 2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑ |
18.下列说法正确的是( )
| A. | 物质发生化学反应都伴随着能量变化 | |
| B. | 伴有能量变化的物质变化都是化学变化 | |
| C. | 放热反应的发生无需任何条件 | |
| D. | 在一个确定的化学反应关系中,反应物的总能量总是高于生成物的总能量 |
 有A、B、C、D四种元素,其中A元素和B元素的原子都有1个未成对电子,A+ 比B- 少一个电子层,B原子得一个电子填入3p轨道后,3p轨道已充满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D的质量分数为 40%,且其核内质子数等于中子数.R是由A、D两元素形成的离子化合物,其中A+ 与D2- 离子数之比为2:1.请回答下列问题:
有A、B、C、D四种元素,其中A元素和B元素的原子都有1个未成对电子,A+ 比B- 少一个电子层,B原子得一个电子填入3p轨道后,3p轨道已充满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D的质量分数为 40%,且其核内质子数等于中子数.R是由A、D两元素形成的离子化合物,其中A+ 与D2- 离子数之比为2:1.请回答下列问题: ,在CB3 分子中C元素原子的原子轨道发生的是sp3 杂化.
,在CB3 分子中C元素原子的原子轨道发生的是sp3 杂化.