题目内容
A、B、C、D、E、F六种元素分布在三个不同的短周期,它们的原子序数依次增大,其中B与C为同一周期,A与D、C与F分别为同一主族,A、D两元素的原子核内的质子数之和是C、F两元素原子核内质子数之和的一半.又知六种元素所形成的常见单质在常温常压下有三种是气体,三种是固体.请回答下列问题:
(1)B元素的原子结构简图 ,
(2)由A、C两元素可以组成X、Y两种化合物,X在一定条件下可以分解成Y,X的电子式为 .
(3)E是非金属元素,但能表现出一些金属元素的性质,请写出工业上制取单质E的化学方程式 .
(4)一定条件下,B、E能形成用于制造轴承、永久模具的新型无机非金属材料,又查资料得知该材料与熔融的氢氧化钠能很快转变为硅酸盐和氨,该反应的化学方程式为 .
(5)写出六种元素中所形成的常见单质,在常温常压下为气体的三种单质间两两反应的化学方程式,并注明反应条件 .
(1)B元素的原子结构简图
(2)由A、C两元素可以组成X、Y两种化合物,X在一定条件下可以分解成Y,X的电子式为
(3)E是非金属元素,但能表现出一些金属元素的性质,请写出工业上制取单质E的化学方程式
(4)一定条件下,B、E能形成用于制造轴承、永久模具的新型无机非金属材料,又查资料得知该材料与熔融的氢氧化钠能很快转变为硅酸盐和氨,该反应的化学方程式为
(5)写出六种元素中所形成的常见单质,在常温常压下为气体的三种单质间两两反应的化学方程式,并注明反应条件
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:A、B、C、D、E、F六种主族元素分布在三个短周期,它们的原子序数依次增大,其中B与C为同一周期,则B、C位于第二周期,A的原子序数小于B,且能够形成化合物,则A为H元素;
C与F位于同一主族,则二者分别处于第二、第三周期,二者原子核内质子数之和的一半为7~13,A与D同主族、且A与D两元素核外电子数之和是C与F两元素原子核内质子数之和的一半,则D的原子序数大于6,应该为Na元素;
故C与F的原子序数之和为:2(1+11)=24,C与F分别位于同一主族,设C的原子序数为x,则x+x+8=24,解得x=8,故C为O元素、F为硫元素;
六种元素所形成的常见单质在常温常压下有三种是气体、三种是固体,原子序数E介于11~16之间,则E单质为固体,所以B单质只能为气体,B与C位于同二周期,C为O元素,B原子序数小于O元素,则B为N元素,
根据(3)E是非金属元素,但能表现出一些金属元素的性质,则E为Si元素,
根据分析可知:A为H、B为N、C为O、D为Na、E为Si、F为S元素.
C与F位于同一主族,则二者分别处于第二、第三周期,二者原子核内质子数之和的一半为7~13,A与D同主族、且A与D两元素核外电子数之和是C与F两元素原子核内质子数之和的一半,则D的原子序数大于6,应该为Na元素;
故C与F的原子序数之和为:2(1+11)=24,C与F分别位于同一主族,设C的原子序数为x,则x+x+8=24,解得x=8,故C为O元素、F为硫元素;
六种元素所形成的常见单质在常温常压下有三种是气体、三种是固体,原子序数E介于11~16之间,则E单质为固体,所以B单质只能为气体,B与C位于同二周期,C为O元素,B原子序数小于O元素,则B为N元素,
根据(3)E是非金属元素,但能表现出一些金属元素的性质,则E为Si元素,
根据分析可知:A为H、B为N、C为O、D为Na、E为Si、F为S元素.
解答:
解:A、B、C、D、E、F六种主族元素分布在三个短周期,它们的原子序数依次增大,其中B与C为同一周期,则B、C位于第二周期,A的原子序数小于B,且能够形成化合物,则A为H元素;C与F位于同一主族,则二者分别处于第二、第三周期,二者原子核内质子数之和的一半为7~13,A与D同主族、且A与D两元素核外电子数之和是C与F两元素原子核内质子数之和的一半,则D的原子序数大于6,应该为Na元素;故C与F的原子序数之和为:2(1+11)=24,C与F分别位于同一主族,设C的原子序数为x,则x+x+8=24,解得x=8,故C为O元素、F为硫元素;六种元素所形成的常见单质在常温常压下有三种是气体、三种是固体,原子序数E介于11~16之间,则E单质为固体,所以B单质只能为气体,B与C位于同二周期,C为O元素,B原子序数小于O元素,则B为N元素,
(1)B为N元素,氮原子的核外电子层数为2、最外层含有5个电子,其原子结构示意图为: ,
,
故答案为: ;
;
(2)A为H、C为O,由A、C两元素可以组成X、Y为水、双氧水,X在一定条件下可以分解成Y,则X为双氧水,双氧水为共价化合物,双氧水的电子式为: ,
,
故答案为: ;
;
(3)E是非金属元素,但能表现出一些金属元素的性质,E的原子序数介于11~16之间,则E为Si元素,工业上用二氧化硅与碳在高温下制取晶体硅,反应的化学方程式为:SiO2+2C
Si+2CO,
故答案为:SiO2+2C
Si+2CO;
(4)B为N、E为Si,一定条件下,B、E能形成用于制造轴承、永久模具的新型无机非金属材料,又查资料得知该材料与熔融的氢氧化钠能很快转变为硅酸盐和氨,则E为Si3N4,该反应的化学方程式为:Si3N4+12NaOH=3Na2SiO3+4NH3+3Na2O,
故答案为:Si3N4+12NaOH=3Na2SiO3+4NH3+3Na2O;
(5)六种元素中所形成的常见单质,在常温常压下为气体的为氮气、氢气和氧气,单质间两两反应的化学方程式为:N2+3H2
2NH3、2H2+O2
2H2O、N2+O2
2NO,
故答案为:N2+3H2
2NH3、2H2+O2
2H2O、N2+O2
2NO.
(1)B为N元素,氮原子的核外电子层数为2、最外层含有5个电子,其原子结构示意图为:
 ,
,故答案为:
 ;
;(2)A为H、C为O,由A、C两元素可以组成X、Y为水、双氧水,X在一定条件下可以分解成Y,则X为双氧水,双氧水为共价化合物,双氧水的电子式为:
 ,
,故答案为:
 ;
;(3)E是非金属元素,但能表现出一些金属元素的性质,E的原子序数介于11~16之间,则E为Si元素,工业上用二氧化硅与碳在高温下制取晶体硅,反应的化学方程式为:SiO2+2C
| ||
故答案为:SiO2+2C
| ||
(4)B为N、E为Si,一定条件下,B、E能形成用于制造轴承、永久模具的新型无机非金属材料,又查资料得知该材料与熔融的氢氧化钠能很快转变为硅酸盐和氨,则E为Si3N4,该反应的化学方程式为:Si3N4+12NaOH=3Na2SiO3+4NH3+3Na2O,
故答案为:Si3N4+12NaOH=3Na2SiO3+4NH3+3Na2O;
(5)六种元素中所形成的常见单质,在常温常压下为气体的为氮气、氢气和氧气,单质间两两反应的化学方程式为:N2+3H2
| ||
| 高温高压 |
| ||
| ||
故答案为:N2+3H2
| ||
| 高温高压 |
| ||
| ||
点评:本题考查结构性质位置关系应用,题目难度中等,涉及常用化学用语、元素化合物性质、化学方程式的书写等知识,推断元素是解题关键,注意基础知识的全面掌握.

练习册系列答案
相关题目
元素的原子结构决定其性质和周期表中的位置.下列说法正确的是( )
| A、元素原子的最外层电予数等于元素的最高化合价 |
| B、电子层数相同的主族元素,最外层电子数多的原子半径小 |
| C、K、Mg、Al失电子能力和最高价氧化物水化物的碱性均依次增强 |
| D、第三周期元素中,最外层电子数≥电子层数的为非金属元素 |
下列有关化学实验的基本操作正确的是( )
| A、配置浓硫酸的酒精溶液时,要将酒精缓慢注入浓硫酸中,并充分搅拌 |
| B、用pH试纸测量某溶液的酸碱度时,必须先用水润湿pH试纸 |
| C、中和滴定实验中,眼睛要始终注视滴定管中液面的变化 |
| D、实验室做醛的银镜反应时,一般采用水浴加热混合液 |
有a,b,c三个电解槽,a中盛有CuSO4溶液,用铜作电极,b和c两槽均盛有AgNO3溶液,用银作电极,先将a、b并联后再与c串联进行电解.若在b中银阴极增重0.108g,c中银阳极减重0.216g 时,对于a中的铜阴极和阳极的正确叙述是( )
| A、铜阴极增重0.064g |
| B、铜阴极增重0.032g |
| C、铜阳极析出气体0.08g |
| D、铜阳极析出气体0.16g |
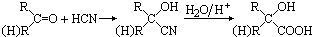 ,CO和H2按物质的量之比1:2可以制得G,有机玻璃可按如图路线合成:
,CO和H2按物质的量之比1:2可以制得G,有机玻璃可按如图路线合成: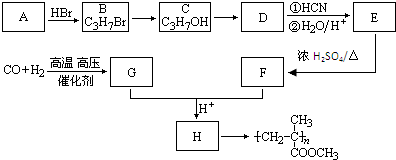
 如图所示,把试管放入盛有25℃时饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5ml盐酸于试管中,试回答下列问题:
如图所示,把试管放入盛有25℃时饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5ml盐酸于试管中,试回答下列问题: