题目内容
4.下列对有关化学反应过程或实验现象的解释正确的是( )| A. | Cl2的水溶液可以导电,说明Cl2是电解质 | |
| B. | 某溶液中加入硝酸酸化的氯化钡溶液有白色沉淀生成说明溶液中一定含有SO42- | |
| C. | 向淀粉碘化钾的溶液中加入氯水,溶液变为蓝色,说明Cl2的氧化性强于I2 | |
| D. | 切开金属钠暴露在空气中,光亮表面逐渐变暗2Na+O2=Na2O2 |
分析 A.氯气是单质;
B.硝酸后会将亚硫酸根氧化成硫酸根离子;
C.氧化剂的氧化性大于氧化产物的氧化性;
D.钠在空气中与氧气反应生成氧化钠.
解答 解:A.氯气是单质,而电解质是针对化合物进行分类的,故A错误;
B.如果溶液中有亚硫酸根离子,在加入硝酸后会被氧化成硫酸根离子,故B错误;
C.根据Cl2+2I-=I2+2Cl-,氧化剂的氧化性大于氧化产物的氧化性,氯气的氧化性强于碘,故C正确;
D.切开的金属钠暴露在空气中,光亮表面逐渐变暗是因为4Na+O2=Na2O,故D错误.
故选C.
点评 本题考查化学实验方案的评价,为高频考点,涉及电解质的概念,离子的检验,钠的化学性质等知识,注意把握物质的性质的异同以及实验的严密性和可行性的评价,难度不大.

练习册系列答案
相关题目
14.设NA为阿伏加德罗常数,下列说法正确的是( )
| A. | 60g二氧化硅晶体中含有2NA个硅氧键 | |
| B. | 1molD2O中含有10NA个质子 | |
| C. | 12g金刚石中含有NA个碳碳键 | |
| D. | 1mol石墨晶体中含有2NA个碳碳键 |
16.有文献记载:在强碱条件下,加热银氨溶液可能析出银镜.某同学进行如下验证和对比实验.
该同学欲分析实验Ⅰ和实验Ⅱ的差异,查阅资料:
a.Ag(NH3)2++2H2O=Ag++2NH3+H2O b.AgOH不稳定,极易分解为黑色Ag2O
(1)配制银氨溶液所需的药品是AgNO3溶液和浓氨水.
(2)经检验,实验Ⅰ的气体中有NH3,黑色物质中有Ag2O.
①用湿润的红色石蕊试纸检验NH3,产生的现象是试纸变蓝.
②产生Ag2O的原因是在NaOH存在下,加热促进NH3•H2O分解,逸出NH3,促使平衡Ag(NH3)2++2H2O?Ag++2NH3•H2O正向移动,c(Ag+)增大,Ag+与OH-反应2OH-+2Ag+=Ag2O+H2O,立即转化为Ag2O.
(3)该同学对产生银镜的原因提出假设:可能是NaOH还原Ag2O.实验及现象:向AgNO3溶液中加入过量NaOH溶液,出现黑色沉淀;水浴加热,未出现银镜.
(4)重新假设:在NaOH存在下.可能是NH3,还原Ag2O.用图1所示装置进行实验.现象:出现银镜.在虚线框内画出用生石灰和浓氨水制取NH3的装置简图(夹持仪器略).

(5)该同学认为在(4)的实验中会有Ag(NH3)2OH生成.由此又提出假设:在NaOH存在下,可能是Ag
(NH3)2OH也参与了NH3还原Ag2O的反应.进行如图2的实验:
①有部分Ag2O溶解在氨水中,该反应的化学方程式是Ag2O+4 NH3•H2O=2Ag(NH3)2OH+3H2O.
②实验结果证实假设成立,依据的现象是与溶液接触的试管壁上析出银镜.
(6)用HNO3消洗试管壁上的Ag,该反应的化学方程式是4HNO3(稀)+3Ag═3AgNO3+NO↑+2H2O.
| 装置 | 实验序号 | 试管中的药品 | 现象 |
 | 实验Ⅰ | 2mL银氨溶液和数 滴较浓NaOH溶液 | 有气泡产生: 一段时间后,溶液 逐渐变黑:试管壁 附着银镜 |
| 实验Ⅱ | 2mL银氮溶液和 数滴浓氨水 | 有气泡产生: 一段时间后,溶液 无明显变化 |
a.Ag(NH3)2++2H2O=Ag++2NH3+H2O b.AgOH不稳定,极易分解为黑色Ag2O
(1)配制银氨溶液所需的药品是AgNO3溶液和浓氨水.
(2)经检验,实验Ⅰ的气体中有NH3,黑色物质中有Ag2O.
①用湿润的红色石蕊试纸检验NH3,产生的现象是试纸变蓝.
②产生Ag2O的原因是在NaOH存在下,加热促进NH3•H2O分解,逸出NH3,促使平衡Ag(NH3)2++2H2O?Ag++2NH3•H2O正向移动,c(Ag+)增大,Ag+与OH-反应2OH-+2Ag+=Ag2O+H2O,立即转化为Ag2O.
(3)该同学对产生银镜的原因提出假设:可能是NaOH还原Ag2O.实验及现象:向AgNO3溶液中加入过量NaOH溶液,出现黑色沉淀;水浴加热,未出现银镜.
(4)重新假设:在NaOH存在下.可能是NH3,还原Ag2O.用图1所示装置进行实验.现象:出现银镜.在虚线框内画出用生石灰和浓氨水制取NH3的装置简图(夹持仪器略).

(5)该同学认为在(4)的实验中会有Ag(NH3)2OH生成.由此又提出假设:在NaOH存在下,可能是Ag
(NH3)2OH也参与了NH3还原Ag2O的反应.进行如图2的实验:
①有部分Ag2O溶解在氨水中,该反应的化学方程式是Ag2O+4 NH3•H2O=2Ag(NH3)2OH+3H2O.
②实验结果证实假设成立,依据的现象是与溶液接触的试管壁上析出银镜.
(6)用HNO3消洗试管壁上的Ag,该反应的化学方程式是4HNO3(稀)+3Ag═3AgNO3+NO↑+2H2O.
14.下列实验能达到目的是( )
| A. | 只滴加氨水鉴别NaCl、AlCl3、MgCl2、Na2SO4四种溶液 | |
| B. | 用澄清石灰水鉴别Na2CO3、NaHCO3两种溶液 | |
| C. | 用萃取分液的方法除去酒精中的水 | |
| D. | 用可见光束照射以区别溶液和胶体 |




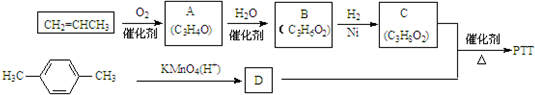
 .①分子式为C4H6O ②含有1个-CH3
.①分子式为C4H6O ②含有1个-CH3 ,反应类型为缩聚反应.
,反应类型为缩聚反应.