题目内容
4.乙醇和甘油、苯酚的共同点是( )| A. | 都能和氢氧化钠发生中和反应 | B. | 都能与金属钠反应产生氢气 | ||
| C. | 都能与FeCl3溶液反应显紫色 | D. | 都属于酚类化合物 |
分析 乙醇和甘油均含-OH,属于醇;而苯酚含酚-OH,具有酸性,与氯化铁发生显色反应,结合酚、醇的性质差异来解答.
解答 解:A.只有苯酚与NaOH发生中和反应,故A不选;
B.均含-OH,均与Na反应生成氢气,故B选;
C.只有苯酚与FeCl3溶液反应显紫色,故C不选;
D.只有苯酚为酚类物质,故D不选;
故选B.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重分析与应用能力的考查,注意酚、醇的性质,题目难度不大.

练习册系列答案
 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南大学出版社系列答案
同步练习西南大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案
相关题目
14.下列说法正确的是( )
| A. | 分子内共价键越强,分子越稳定,其熔沸点也越高 | |
| B. | 离子键的本质就是阴、阳离子之间的相互吸引 | |
| C. | 变化过程中化学键被破坏,则一定发生化学变化 | |
| D. | 由原子构成的晶体可能是原子晶体,也可能是分子晶体 |
19.X、Y、Z、R、W是5种短周期主族元素,原子序数依次增大;它们可组成离子化合物Z2Y和共价化合物RY3、XW4;已知Y、R同主族,Z、R、W同周期,下列说法错误的是( )
| A. | 原子半径:Z>R>W | |
| B. | 气态氢化物稳定性:HnW>HmR | |
| C. | X2W6分子中各原子最外层电子均满足8电子结构 | |
| D. | Y、Z形成的化合物中只含离子键 |
9.①丙烷,②正丁烷,③正戊烷,按沸点的高低顺序排列正确的是( )
| A. | ①>②>③ | B. | ③>②>① | C. | ③>①>② | D. | ②>①>③ |
16.A、B、C、D四种短周期主族元素的原子序数依次减小;在短周期的主族元素中D的原子半径最大;C原子最外层电子数与电子层数相等;B元素的主要化合价:最高正价+最低负价=4.下列说法正确的是( )
| A. | A、C、D最高价氧化物对应的水化物两两之间能发生反应 | |
| B. | D和A能形成原子个数比为2:1型的离子化合物 | |
| C. | 最高价氧化物对应的水化物的酸性:B>A | |
| D. | C的氧化物是碱性氧化物 |
13.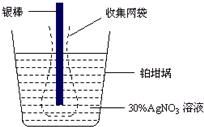 精确测量金属离子在惰性电极上以镀层形式沉积的金属质量,可以确定电解过程中通过电解池的电量.实际测量中常用的银电量计结构如图所示,则下列说法正确的是( )
精确测量金属离子在惰性电极上以镀层形式沉积的金属质量,可以确定电解过程中通过电解池的电量.实际测量中常用的银电量计结构如图所示,则下列说法正确的是( )
 精确测量金属离子在惰性电极上以镀层形式沉积的金属质量,可以确定电解过程中通过电解池的电量.实际测量中常用的银电量计结构如图所示,则下列说法正确的是( )
精确测量金属离子在惰性电极上以镀层形式沉积的金属质量,可以确定电解过程中通过电解池的电量.实际测量中常用的银电量计结构如图所示,则下列说法正确的是( )| A. | 电量计中的银棒应与电源的正极相连,铂棒上发生的电极反应式为:2H++NO3-+e-=NO2↑+H2O | |
| B. | 已知每摩尔电子的电量为96 500 C,若反应进行10分钟,称量电解前后铂坩埚的质量变化值为108.0 mg,则电解过程中的平均电流约为9.65A | |
| C. | 若要测定电解精炼铜时通过的电量,可将银电量计中的银棒与待测电解池的精铜电极相连 | |
| D. | 实验中,为了避免银溶解过程中可能产生的金属颗粒掉进铂坩埚而导致测量误差,常在银电极附近增加一个收集网袋.若没有收集网袋,测量结果会偏低 |
