题目内容
7.25℃时,几种物质的电离平衡常数如表:| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 Ka2=5.6×10-11 | Ka=3.0×10-8 |
| A. | HClO的漂白性是因为酸性很弱 | |
| B. | 相同浓度的Na2CO3与NaHCO3溶液,后者的pH更大 | |
| C. | 反应 2C1O-+CO2+H2O=CO32-+2HClO可以发生 | |
| D. | 稀释醋酸溶液,则$\frac{{c(C{H_3}CO{O^-})}}{{c(C{H_3}COOH)}}$的数值随水量的增加而增大 |
分析 A、HClO的漂白性是因为其具有强氧化性;
B、碳酸钠的水解程度大于碳酸氢钠;
C、H2CO3的Ka2=5.6×10-11,而HClO的Ka=3.0×10-8,所以次氯酸的酸性强碳酸氢根离子的酸性;
D、加水稀释醋酸溶液促进电离,醋酸的物质的量减小,而醋酸根的物质的量增加,所以$\frac{{c(C{H_3}CO{O^-})}}{{c(C{H_3}COOH)}}$=$\frac{n(C{H}_{3}CO{O}^{-})}{n(C{H}_{3}COOH)}$增大;
解答 解:A、HClO的漂白性是因为其具有强氧化性,而不是弱酸性,故A错误;
B、碳酸钠的水解程度大于碳酸氢钠,所以相同浓度的Na2CO3与NaHCO3溶液,前者的pH更大,故B错误;
C、H2CO3的Ka2=5.6×10-11,而HClO的Ka=3.0×10-8,所以次氯酸的酸性强碳酸氢根离子的酸性,则可以发生C1O-+CO2+H2O=HCO3-+HClO,故C错误;
D、加水稀释醋酸溶液促进电离,醋酸的物质的量减小,而醋酸根的物质的量增加,所以$\frac{{c(C{H_3}CO{O^-})}}{{c(C{H_3}COOH)}}$=$\frac{n(C{H}_{3}CO{O}^{-})}{n(C{H}_{3}COOH)}$增大,即稀释醋酸溶液,则$\frac{{c(C{H_3}CO{O^-})}}{{c(C{H_3}COOH)}}$的数值随水量的增加而增大,故D正确;
故选D.
点评 本题考查了弱电解质的电离及盐类水解,明确酸的强弱与酸根离子水解程度关系是解本题关键,注意外界条件对电离平衡移动的影响.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
17.有机化合物的结构可用键线式表示,如CH2═CHCH2Br可表示为 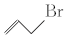 .则关于有机物
.则关于有机物  的说法正确的有( )
的说法正确的有( )
 .则关于有机物
.则关于有机物  的说法正确的有( )
的说法正确的有( )| A. | 与苯互为同分异构体 | B. | 其二氯代物有3种 (不考虑立体异构) | ||
| C. | 分子中所有的碳原子在同一平面上 | D. | 属于烯烃,是乙烯的同系物 |
15.光照条件下,甲烧与氯气在容积不变的密闭容器中可发生反应: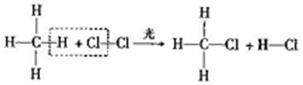
下到说法错误的是( )
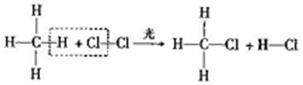
下到说法错误的是( )
| A. | 该反应中三种元素的非金属性:Cl>C>H | |
| B. | 该反应中有两种旧化学键断裂,同时有两种新化学键形成 | |
| C. | 该反应中,反应物和生成物中均只含共价键 | |
| D. | 该反应中,反应物和生成物均为共价化合物 |
2.化学与生活息息相关,下列说法正确的是( )
| A. | 食盐可作调味剂,也可以用作食品防腐剂 | |
| B. | 碳酸钾有一定的去污能力,在热水中去污能力会减弱 | |
| C. | 煤经过气化和液化等变化后,可以减少PM2.5引起的污染 | |
| D. | 根据纤维燃烧产生的气味,不能确定是否为蛋白质纤维 |
19.一定量的H2在Cl2中燃烧后,所得混合气体用100mL3.00mol∕L的NaOH溶液恰好完全吸收,测得溶液中含0.05mol NaClO(不考虑水解).氢气和氯气物质的量之比是( )
| A. | 2:3 | B. | 3:1 | C. | 1:1 | D. | 3:2 |
7.下列图示与对应的叙述符合的是( )
| A. | 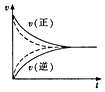 用实线、虚线分别表示某可逆反应未使用催化剂和使用催化剂的正、逆反应速率随时间的变化 | |
| B. | 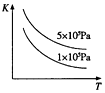 表示反应2SO2(g)+O2(g)?2SO3(g)△H<0的平衡常数K与温度和压强的关系 | |
| C. | 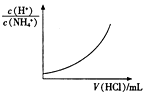 表示向0.1mol/L的NH4Cl溶液中滴加0.1mol/L的HCl溶液时,溶液中$\frac{c({H}^{+})}{c(N{H}_{4}^{+})}$随HCl溶液体积变化关系 | |
| D. | 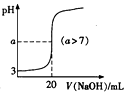 表示常温下向20mL pH=3的醋酸中滴加pH=11的NaOH溶液,溶液的pH随NaOH溶液体积的变化关系 |
 酚酞是白色结晶,在空气中稳定,几乎不溶于水,常用做酸碱指示剂,其结构简式如图:
酚酞是白色结晶,在空气中稳定,几乎不溶于水,常用做酸碱指示剂,其结构简式如图: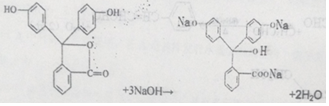 .
.