题目内容
8. 氨是重要的化工原料,用途广泛.
氨是重要的化工原料,用途广泛.(1)合成氨工厂常用醋酸二氨合铜(由[Cu(NH3)2]+和CH3COO-构成)溶液吸收对氨合成催化剂(铁粉)有毒害的CO气体.
①醋酸二氨合铜所含的元素中,第一电离能最大的是N.(填元素符号)
②醋酸二氨合铜所含元素的单质,所属的晶体类型有bcd(填序号).
a.离子晶体 b.分子晶体 c.原子晶体 d.金属晶体
③第4周期中,基态原子与基态Cu原子未成对电子数目相同的元素有4种(不包括Cu).
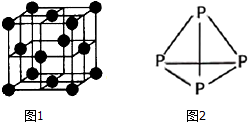
④铜单质为面心立方晶体,其晶胞如图1.如果Cu的原子半径为a cm,阿伏加德常数的值为NA,则此种Cu单质的密度表达式为$\frac{8\sqrt{2}}{{a}^{3}×{N}_{A}}$g/cm3.(相对原子质量Cu:64)
(2)BF3气体与NH3相遇立即生成一种白色晶体:
BF3+NH3=F3B-NH3.写出两种与BF3具有相同空间构型的阴离子CO32-、、NO3-.
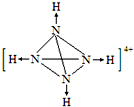
(3)NH3可用于合成尿素、硫酸铵等氮肥.某化肥厂从生产的硫酸铵中检出一种组成为N4H4(SO4)2的物质.该物质在水溶液中以SO42-和N4H44+两种正四面体构型的离子存在.N4H44+遇碱生成一种形似白磷的N4分子.在图2画出N4H44+的结构(标明其中的配位键)
 .
.
分析 (1)①非金属性越强,第一电离能越大,同周期随原子序数增大,元素第一电离能呈增大趋势,氮元素原子2p能级为半满稳定状态,第一电离能高于同周期相邻元素的;
②醋酸二氨合铜所含元素的单质有Cu、氢气、氮气、氧气、金刚石、石墨等;
③基态Cu原子未成对电子数目为1,第4周期中,其它基态原子含有1个单电子的外围电子排布为4s1、3d14s2、4s24p1、4s24p5;
④根据均摊法计算晶胞中Cu原子数目,表示出晶胞质量,处于面对角线上的原子相邻,Cu的原子半径为a cm,则晶胞棱长为4a cm×$\frac{\sqrt{2}}{2}$=2$\sqrt{2}$a cm,再根据ρ=$\frac{m}{V}$计算密度;
(2)与BF3具有相同空间构型的阴离子,可以是互为等电子体的微粒;
(3)将白磷分子中P原子替换成N原子,每个N原子与H原子之间形成配位键.
解答 解:(1)①非金属性越强,第一电离能越大,同周期随原子序数增大,元素第一电离能呈增大趋势,氮元素原子2p能级为半满稳定状态,第一电离能高于同周期相邻元素的,故第一电离能由小到大的顺序为:Cu<H<C<O<N,所以第一电离能最大的是N;
故答案为:氮;
②醋酸二氨合铜所含元素的单质有Cu、氢气、氮气、氧气、金刚石、石墨等,铜属于金属晶体,金刚石属于原子晶体,氧气和氢气属于分子晶体;
故答案为:b、c、d;
③Cu的外围电子排布为3d104s1,只有1个未成对电子,第4周期元素中,其它基态原子含有1个单电子的外围电子排布为4s1、3d14s2、4s24p1、4s24p5,分别为K、Sc、Ga、Br,共有4种元素;
故答案为:4;
④晶胞中Cu原子数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,晶胞质量为4×$\frac{65}{{N}_{A}}$g,处于面对角线上的原子相邻,Cu的原子半径为a cm,则晶胞棱长为4a cm×$\frac{\sqrt{2}}{2}$=2$\sqrt{2}$a cm,则晶体密度为:4×$\frac{64}{{N}_{A}}$g,÷(2$\sqrt{2}$a cm)3=$\frac{8\sqrt{2}}{{a}^{3}×{N}_{A}}$g/cm3,
故答案为:$\frac{8\sqrt{2}}{{a}^{3}×{N}_{A}}$;
(2)与BF3具有相同空间构型的阴离子,可以是互为等电子体的微粒,如CO32-、NO3-等,
故答案为:CO32-、NO3-;
(3)将白磷分子中P原子替换成N原子,没有N原子与H原子之间形成配位键,N4H44+的结构为: ,
,
故答案为: .
.
点评 本题是对物质结构与性质的考查,涉及第一电离能、晶体类型判断、核外电子排布、等电子体运用、微粒的空间结构、配位键、晶胞计算等,是对物质结构主干知识的综合考查,(2)中注意根据等电子体进行解答.

 一本好题口算题卡系列答案
一本好题口算题卡系列答案| A. | ①>②>③>⑤>④ | B. | ②>③>⑤>④>① | C. | ③>①>②>⑤>④ | D. | ④>⑤>②>①>③ |
| A. | ④⑤③ | B. | ⑥①⑤③ | C. | ⑧①⑦ | D. | ⑧②⑤③ |
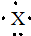 ,则该元素组成的以下物质中,化学式肯定错误的是( )
,则该元素组成的以下物质中,化学式肯定错误的是( )| A. | 含氧酸的化学式可能为HXO3 | B. | 含氧酸的化学式可能为H3XO4 | ||
| C. | 气态氢化物化学式为XH5 | D. | 最高价氧化物的化学式为X2O5 |
| A. | 苯与浓硝酸在浓硫酸作用下共热至50~60℃属于加成反应 | |
| B. | 乙烯通入溴水中,使溴水褪色属于取代反应 | |
| C. | 苯在一定条件和氢气反应,属于加成反应 | |
| D. | 乙烯和水在一定条件下反应生成乙醇属于氧化反应 |
 一定温度下,在2L的密闭容器中,A、B、D三种气体的物质的量随时间变化的曲线如图所示.下列表述正确的是( )
一定温度下,在2L的密闭容器中,A、B、D三种气体的物质的量随时间变化的曲线如图所示.下列表述正确的是( )| A. | 反应的化学方程式为A(g)+B(g)?D(g) | |
| B. | 反应开始到10s,用B表示的反应速率为0.079mol/(L•s) | |
| C. | 在10s时,D的体积分数为71.8% | |
| D. | 反应开始到10s时,A的转化率为79% |
| A. | 含C=C的物质一定是烯烃 | B. | 最简式为C3H6的物质一定是丙烯 | ||
| C. | CH≡CCH2Cl属于不饱和烃 | D. | 烯烃中一定含C=C |