题目内容
16.欲从苯酚的乙醇溶液中分离苯酚和乙醇,有下列操作:①蒸馏 ②过滤 ③静置分液 ④加入足量的金属钠 ⑤通入过量的二氧化碳 ⑥加入足量的NaOH溶液 ⑦加入足量的FeCl3 溶液 ⑧加入乙酸与浓硫酸混合液加热.合理的实验操作步骤及顺序是( )| A. | ④⑤③ | B. | ⑥①⑤③ | C. | ⑧①⑦ | D. | ⑧②⑤③ |
分析 乙醇不会和氢氧化钠溶液反应,苯酚和氢氧化钠溶液反应,全部变成苯酚钠,原来的溶液就变成了苯酚钠、氢氧化钠溶液(加入氢氧化钠溶液是过量的)中混有乙醇.根据乙醇和水的沸点不同,加热蒸馏乙醇被全部蒸馏掉,而剩下的苯酚钠、苛性钠溶液,最后通入过量的二氧化碳气体,苯酚钠全部转化为苯酚,苯酚不溶水,与生成的NaHCO3溶液分层,静置后分液可以得到苯酚.
解答 解:从苯酚的乙醇溶液中分离苯酚和乙醇,需要的步骤为:
⑥加入足量的NaOH溶液,苯酚与NaOH反应生成苯酚钠,乙醇与NaOH溶液不反应,加热苯酚钠不挥发,乙醇的沸点较低,能挥发;
①蒸馏,冷凝蒸汽,得到乙醇;
⑤苯酚钠溶液中通入过量的二氧化碳,生成苯酚、碳酸氢钠,苯难溶于水;
③静置分液,得到苯酚,
故选B.
点评 本题考查混合物分离提纯实验方案的设计,为高频考点,把握有机物的性质及混合物分离方法、原理为解答的关键,注意蒸馏、分液的应用,题目难度不大.

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目
6.原子结构、元素周期律和元素周期表对于我们化学学习具有理论指导意义,下列有关说法正确的是( )
| A. | 同周期的主族元素从左到右原子半径逐渐减小,它们形成简单的离子半径逐渐增大 | |
| B. | 可以根据主族元素原子的电子层数和最外层电子数确定其在周期表中的位置 | |
| C. | 由氟、氯两元素在周期表中位置关系推知,氟元素非金属性强于氯元素,所以氢氟酸的酸性应强于盐酸 | |
| D. | 在实际生产中,多在元素周期表的过渡元素区寻找新型半导体材料 |
1.关于分子2H218O2的说法正确的是( )
| A. | 该分子的摩尔质量约为40 | B. | 该分子由H2和O2构成 | ||
| C. | 1 mol该分子中含有22 mol中子 | D. | 1 mol该分子中含有20 mol电子 |
5.下列叙述中正确的是( )
| A. | 由非金属元素组成的化合物中一定不含离子键 | |
| B. | 离子化合物一定含有金属元素 | |
| C. | 分子中一定含有共价键 | |
| D. | 某种离子化合物可以同时含有离子键、极性共价键 |
6.将淀粉和淀粉酶的混合物放入玻璃纸袋中,扎好袋口,浸入流动的温水中.相当一段时间后,取袋内液体分别与碘水、新制Cu(OH)2(加热)作用,其现象分别是( )
| A. | 显蓝色、无现象 | B. | 显蓝色、红色沉淀 | ||
| C. | 无现象、变黑色 | D. | 无现象、红色沉淀 |

 .
.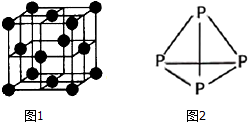 氨是重要的化工原料,用途广泛.
氨是重要的化工原料,用途广泛.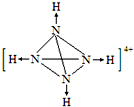 .
.