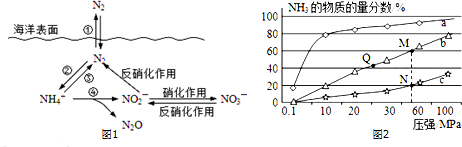
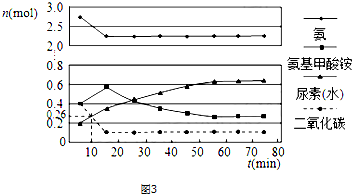
题目内容
4.56g Fe与足量稀盐酸混和充分反应,求所消耗HCl的物质的量是多少mol?产生的H2在标况下的体积是多少L?分析 发生反应:Fe+2HCl═FeCl2+H2↑,根据n=$\frac{m}{M}$计算Fe的物质的量,根据方程式计算消耗HCl、生成氢气的物质的量,再根据V=nVm计算生成氢气的体积.
解答 解:56gFe的物质的量=$\frac{56g}{56g/mol}$=1mol,
令消耗HCl的物质的量为x,生成氢气的物质的量为y,则:
Fe+2HCl═FeCl2+H2↑
1 2 1
1mol x y
所以x=$\frac{1mol×2}{1}$=2mol,
y=$\frac{1mol×1}{1}$=1mol,
标况下1mol氢气的体积=1mol×22.4L/mol=22.4L,
答:消耗HCl的物质的量为2mol,标况下生成氢气的体积为22.4L.
点评 本题考查了物质的量的计算、化学方程式的计算,题目难度不大,明确发生反应的实质为解答关键,注意掌握物质的量与摩尔质量、气体摩尔体积的关系,试题培养了学生的化学计算能力.

练习册系列答案
相关题目
14.下列说法正确的是( )
| A. | 只含一种元素的物质一定是单质 | B. | 只含一种分子的物质一定纯净物 | ||
| C. | 非金属氧化物一定是酸性氧化物 | D. | 有单质生成的反应一定是置换反应 |
15.下列过程是自发进行的吸热反应的是( )
| A. | NaOH与HCl 反应 | B. | CO与O2点燃 | ||
| C. | Ba(OH)2•8H2O与NH4NO3反应 | D. | SO3与H2O反应 |
12.下列变化过程中,是吸热过程的是( )
| A. | H+H→H2 | B. | H+Cl→HCl | C. | I2→I+I | D. | S+O2→SO2 |
19.下列各物质中,所含氧原子个数最多的是( )
| A. | 1 mol KClO3 | B. | 49g H3PO4 | ||
| C. | 标准状况下5.6L氧气 | D. | 3.01×1023个CO2 |
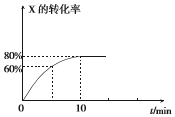 恒定温度为T1℃时,在容积为10L的密闭容器中充人1.0mol X和0.80mol Y,发生反应:
恒定温度为T1℃时,在容积为10L的密闭容器中充人1.0mol X和0.80mol Y,发生反应: