题目内容
12.“8•12”天津港危化仓库爆炸,造成生命、财产的特大损失.据查危化仓库中存有大量的钠、钾,硝酸铵和氰化钠(NaCN).请回答下列问题:(1)钠、钾着火,下列可用来灭火的是D.
A.水 B.泡沫灭火器 C.干粉灭火器 D.细沙盖灭
(2)NH4NO3为爆炸物,在不同温度下加热分解,可能发生非氧化还原反应,可能发生氧化还原反应,下列反应可能发生的是A、B、D、F.
A.NH4NO3→N2+O2+H2O
B.NH4NO3→NH3+HNO3
C.NH4NO3→O2+HNO3+H2O
D.NH4NO3→N2+HNO3+H2O
E.NH4NO3→N2+NH3+H2O
F.NH4NO3→N2O+H2O
(3)NaCN属于剧毒物质,有多种无害化处理方法.
①H2O2处理法:NaCN+H2O2--N2↑+X+H2O推测X的化学式为NaHCO3.
②NaClO处理法:aCN-+bClO-+2cOH-=dCNO-+eN2↑+fCO32-+bCl-+cH2O方程式中e:f的值为B(填选项标号).
A.1 B.1/2 C.2 D.不能确定
(4)以TiO2为催化剂用NaClO将CN-离子氧化成CNO-,CNO-在酸性条件下继续与NaClO反应生成N2、CO2、Cl2等.取浓缩后含CN-离子的废水与过量NaClO溶液的混合液共200mL(设其中CN-的浓度为0.2mol•L-1)进行实验.写出CNO-在酸性条件下被NaClO氧化的离子方程式:2CNO-+6ClO-+8H+═N2↑+2CO2↑+3Cl2↑+4H2O.
分析 (1)Na、K能和水反应生成氢气,在氧气中燃烧生成过氧化物,过氧化钠和水、二氧化碳反应都生成氧气,促进钠、钾燃烧;
(2)NH4NO3分解,一种可能是发生复分解反应,还有一种可能是氧化还原反应,根据氧化还原反应中有元素化合价升高就必须有元素化合价降低的原则进行判断;
(3)①结合原子守恒分析X的化学式;
②由CN-离子中碳与氮原子之比为1:1,而碳氮转化为CNO-和N2以及CO32-,因为CNO-离子碳氮之比为1:1,所以N2和CO32-两微粒之比为1:2;
(4)根据题意可知,酸性条件下CNO-与NaClO反应生成N2、CO2和Cl2,根据氧化还原反应配平.
解答 解:(1)Na、K能和水反应生成氢气,在氧气中燃烧生成过氧化物,过氧化钠和水、二氧化碳反应都生成氧气,促进钠、钾燃烧,所以应该采用细沙灭火,
故答案为:D;
(2)NH4NO3分解,一种可能是发生复分解反应,还有一种可能是氧化还原反应,根据氧化还原反应中有元素化合价升高就必须有元素化合价降低的原则进行判断:
A、NH4NO3→N2+O2+H2O中N从+5价降为0价,N从-3升为0价,O从-2升为0价,符合氧化还原反应的特征,故正确;
B、NH4NO3→NH3+HNO3满足复分解反应的条件,故正确;
C、NH4NO3→O2+HNO3+H2O中只有化合价升高的,没有化合价降低的,故错误;
D、NH4NO3→N2+HNO3+H2O中N从+5价降为0价,N从-3升为0价,符合氧化还原反应的特征,故正确;
E、NH4NO3→N2+NH3+H2O中虽然N从+5价降为0价,N从-3升为0价,但由于每个N升高的数值小于降低的数值,即消耗的铵根的物质的量要比硝酸根离子多,所以不可能有NH3产生,故错误;
F、NH4NO3→N2O+H2O中N从+5价降为+1价,N从-3升为+1价,符合氧化还原反应的特征,故正确;
故答案为:A、B、D、F;
(3)①NaCN+H2O2--N2↑+X+H2O中,由原子守恒可知X为NaHCO3,故答案为:NaHCO3;
②由CN-离子中碳与氮原子之比为1:1,而碳氮转化为CNO-和N2以及CO32-,以因为CNO-离子碳氮之比为1:1,所以N2和CO32-两微粒之比为1:2,所以e:f=1:2,
故答案为:B;
(4)根据题意可知,酸性条件下CNO-与NaClO反应生成N2、CO2和Cl2,反应离子方程式为2CNO-+6ClO-+8H+═N2↑+2CO2↑+3Cl2↑+4H2O,
故答案为:2CNO-+6ClO-+8H+═N2↑+2CO2↑+3Cl2↑+4H2O.
点评 本题综合考查了氧化还原反应,涉及氧化还原反应的基本概念、氧化还原反应方程式配平、物质性质等知识点,注意NaCN中C、N元素化合价分别是+2价、-3价,为易错点,题目难度中等,侧重于考查学生的分析能力和对基础知识的应用能力.

 阅读快车系列答案
阅读快车系列答案| A. | 红磷和白磷 | B. | ${\;}_{1}^{1}$H和${\;}_{1}^{2}$H | ||
| C. | H2O和D2O | D. | ${\;}_{8}^{16}$O和${\;}_{8}^{18}$O |
| A. | CuO | B. | Al2O3 | C. | CaO | D. | SiO2 |
| A. | 原电池中电子流出的一极是正极 | |
| B. | 原电池是将化学能转变为电能的装置 | |
| C. | 构成原电池的正极和负极必须是两种不同的金属 | |
| D. | 原电池放电时,电流的方向是从负极到正极 |
| A. | 该有机物中一定含有氧元素 | |
| B. | 该有机物分子中碳氢原子数之比为1:3 | |
| C. | 该有机物中一定不含有氧元素 | |
| D. | 该有机物分子式为C2H6 |
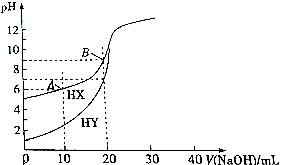
| A. | 相同条件下,HX和HY中和碱的能力相同 | |
| B. | 常温下,HX的电离平衡常数K=1×10-9mol•L-1 | |
| C. | 点存在:c(X-)-c(HX)>c(H+)-c(0H-) | |
| D. | 向B点溶液通人HCl气体至中性:c(HX)+c(Cl-)+2c(X-)=0.2mol•L-1A |
| A. | 该物质属于纯净物 | B. | 该物质可能属于无机化合物 | ||
| C. | 该物质是由同一类烃组成的混合物 | D. | 烟是该物质不完全燃烧的产物 |
| A. | 侯氏制碱、肥皂的制取工艺过程中均应用了物质溶解度的差异 | |
| B. | 使用可再生资源、用超临界二氧化碳替代有机溶剂、注重原子的经济性、采用低能耗生产工艺等都是绿色化学的内容 | |
| C. | 石油分馏、煤的气化、海水晒盐、碱去油污、花生中提取花生油等过程都是物理变化 | |
| D. | 合金超导材料是指熔合两种或两种以上的金属元素并形成具有超导电性的超导材料,如铌一钛(Nb-Ti)合金,通常它的熔点一般比纯钛要高. |