题目内容
7.某有机物在氧气中充分燃烧,消耗的氧气与生成二氧化碳及水蒸气的物质的量之比为3:2:3,则下列说法中正确的是( )| A. | 该有机物中一定含有氧元素 | |
| B. | 该有机物分子中碳氢原子数之比为1:3 | |
| C. | 该有机物中一定不含有氧元素 | |
| D. | 该有机物分子式为C2H6 |
分析 假设生成二氧化碳为2mol,生成水为3mol,消耗氧气为3mol,根据O原子守恒可知有机物中含有O原子为2mol×2+3mol×1-3mol×2=1mol,则有机物中C、H、O原子数目之比为2mol:6mol:1mol=2:6:1,该有机物的最简式为C2H6O,由于2个C原子最多连接6个氢原子,故有机物分子式为C2H6O.
解答 解:假设生成二氧化碳为2mol,生成水为3mol,消耗氧气为3mol,根据O原子守恒可知有机物中含有O原子为2mol×2+3mol×1-3mol×2=1mol,则有机物中C、H、O原子数目之比为2mol:6mol:1mol=2:6:1,该有机物的最简式为C2H6O,由于2个C原子最多连接6个氢原子,故有机物分子式为C2H6O.
A.由上述分析可知,该有机物中一定含有氧元素,故A正确;
B.该有机物分子中碳氢原子数之比为1:3,故B正确;
C.该有机物中一定含有氧元素,故C错误;
D.有机物分子式为C2H6O,故D错误.
故选:AB.
点评 本题考查有机物分子式的确定,根据原子守恒确定最简式,注意若最简式中H原子饱和C的四价结构,最简式即为分子式.

练习册系列答案
 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案
相关题目
17.已知氢元素有3种同位素,氧元素也有3种同位素.假定能准确测定单个水分子的质量,则所测得数据将有种( )
| A. | 6种 | B. | 7种 | C. | 18种 | D. | 27种 |
15.下列电池不属于化学电池的是( )
| A. | 一次电池 | B. | 二次电池 | C. | 燃料电池 | D. | 太阳能电池 |
16.苹果酸的结构简式如图所示,下列说法正确的是( )


| A. | 苹果酸的分子式为C4H8O5 | |
| B. | 苹果酸能与Na、NaOH反应,但不能与NaHCO3反应 | |
| C. | 苹果酸既能发生酯化反应,又能缩聚成高分子化合物 | |
| D. | 2分子苹果酸相互反应可形成两种环状的酯类物质 |
20.已知2mol氢气完全燃烧生成水蒸气时放出能量484kJ,且氧气中1mol O═O键完全断裂时吸收能量496kJ,水蒸气中1mol H-O键形成时放出能量463kJ,则氢气中1mol H-H键断裂时吸收能量为( )
| A. | 920 kJ | B. | 557 kJ | C. | 436 kJ | D. | 188 kJ |
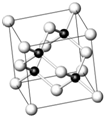 砷化镓为第三代半导体,以其为材料制造的灯泡寿命长,耗能少.已知砷化镓的晶胞结构如图所示.请回答下列问题:
砷化镓为第三代半导体,以其为材料制造的灯泡寿命长,耗能少.已知砷化镓的晶胞结构如图所示.请回答下列问题: