题目内容
酸性H2CO3>HClO>HCO3-,判断在等浓度的NaClO、NaHCO3混合溶液中,各种离子浓度关系正确的是( )
| A、c(Na+)>c(HCO3-)>c(H+)>c(OH-) |
| B、c(HCO3-)>c(ClO-)>c(OH-) |
| C、c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3) |
| D、c(Na+)+c(H+)=c(HCO3-)+c(ClO-)+c(OH-)+2c(CO32-) |
考点:离子浓度大小的比较,盐类水解的应用
专题:盐类的水解专题
分析:A.碳酸钠、碳酸氢钠在溶液中水解,溶液显示碱性,则c(OH-)>c(H+);
B.碳酸氢根离子、次氯酸根离子都水解生成氢氧根离子,则氢氧根离子浓度大于碳酸氢根离子和次氯酸根离子;
C.混合液中满足物料守恒,根据混合液中的物料守恒进行判断;
D.溶液中一定满足电荷守恒,根据混合液中的电荷守恒判断.
B.碳酸氢根离子、次氯酸根离子都水解生成氢氧根离子,则氢氧根离子浓度大于碳酸氢根离子和次氯酸根离子;
C.混合液中满足物料守恒,根据混合液中的物料守恒进行判断;
D.溶液中一定满足电荷守恒,根据混合液中的电荷守恒判断.
解答:
解:A.NaClO、NaHCO3都属于强碱弱酸盐,溶液呈碱性,则c(OH-)>c(H+),故A错误;
B.H2CO3的酸性大于HClO,则ClO-的水解程度大于HCO3-,两者水解都产生氢氧根离子,则c(OH-)>c(HCO3- )>c(ClO-),故B错误;
C.物质的量浓度相等的NaClO、NaHCO3混合溶液中,根据物料守恒得c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)+c(CO32-),故C错误;
D.由电荷守恒可知:c(Na+)+c(H+)=c(HCO3-)+c(ClO-)+c(OH-)+2c(CO32-),故D正确;
故选D.
B.H2CO3的酸性大于HClO,则ClO-的水解程度大于HCO3-,两者水解都产生氢氧根离子,则c(OH-)>c(HCO3- )>c(ClO-),故B错误;
C.物质的量浓度相等的NaClO、NaHCO3混合溶液中,根据物料守恒得c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)+c(CO32-),故C错误;
D.由电荷守恒可知:c(Na+)+c(H+)=c(HCO3-)+c(ClO-)+c(OH-)+2c(CO32-),故D正确;
故选D.
点评:本题考查了溶液中离子浓度大小比较,题目难度中等,注意掌握盐的水解原理及判断溶液中离子浓度大小的方法,明确电荷守恒、物料守恒、质子守恒的含义及应用方法.

练习册系列答案
 名校通行证有效作业系列答案
名校通行证有效作业系列答案
相关题目
按碳骨架分类,下列说法正确的是( )
| A、CH3CH(CH3)2属于烯烃 |
B、 属于芳香族化合物 属于芳香族化合物 |
C、 属于脂环化合物 属于脂环化合物 |
D、 属于芳香化合物 属于芳香化合物 |
下列物质的主要成分不是SiO2的是( )
| A、水晶 | B、石英 | C、沙子 | D、干冰 |
常温下,下列各组数据中比值为2:1的是( )
| A、Na2O2晶体中阴阳离子个数比2:1 |
| B、0.2mol?L-1的CH3COOH溶液与0.1mol?L-1CH3COOH溶液中c(H+)之比 |
| C、pH=7的氨水与(NH4)2SO4的混合溶液中,c(NH4+)与c(SO42-)之比 |
| D、pH=11的Ba(OH)2溶液与pH=12的KOH溶液中溶质的物质的量浓度之比 |
与6.4g SO2所含的氧原子数相等的NO2的质量是( )
| A、3.2g | B、4.6g |
| C、6.4g | D、2.3g |
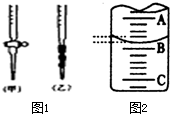 某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下: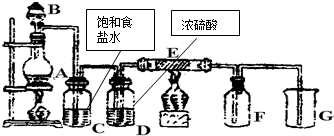 如图是实验室制取并收集Cl2的装置.A是Cl2发生装置,E是硬质玻璃管中装有细铁丝网;F为干燥的广口瓶,烧杯G为尾气吸收装置.
如图是实验室制取并收集Cl2的装置.A是Cl2发生装置,E是硬质玻璃管中装有细铁丝网;F为干燥的广口瓶,烧杯G为尾气吸收装置.