题目内容
(以下填写化学式)如果胃酸过多,可服用 缓解症状,如果患有胃溃疡,则不能服用 ,防止胃穿孔.
考点:镁、铝的重要化合物,药物的主要成分和疗效
专题:几种重要的金属及其化合物
分析:氢氧化铝和盐酸反应生成三氯化铝和水;小苏打(NaHCO3)和盐酸反应生成氯化钠水和二氧化碳.
解答:
解:氢氧化铝和盐酸反应生成三氯化铝和水:Al(OH)3+HCl=AlCl3+H2O,小苏打(NaHCO3)和盐酸反应生成氯化钠水和二氧化碳:NaHCO3+HCl=NaCl+H2O+CO2↑,生成二氧化碳会引起胃穿孔,故答案为:氢氧化铝;小苏打.
点评:本题考查碳酸氢钠、氢氧化铝和酸反应,题目比较简单.

练习册系列答案
 提分百分百检测卷系列答案
提分百分百检测卷系列答案
相关题目
乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物.下列说法正确的是( )
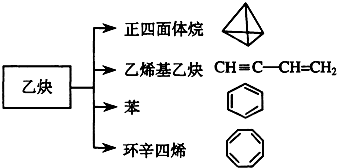

| A、正四面体烷的二氯取代产物有2种 |
| B、正四面体烷与乙烯基乙炔互为同分异构体 |
| C、苯与环辛四烯互为同系物 |
| D、等质量的苯与环辛四烯完全燃烧消耗氧气量不相同 |
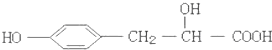 某有机物的结构简式如图,它可能发生的反应类型有:①取代反应;②加成反应;③消去反应;④水解反应;⑤酯化反应;⑥中和反应;⑦氧化反应;⑧加聚反应.( )
某有机物的结构简式如图,它可能发生的反应类型有:①取代反应;②加成反应;③消去反应;④水解反应;⑤酯化反应;⑥中和反应;⑦氧化反应;⑧加聚反应.( )| A、①②③④⑥ |
| B、②③④⑥⑧ |
| C、①②③⑤⑥⑦ |
| D、③⑤⑥⑦⑧ |
酸性H2CO3>HClO>HCO3-,判断在等浓度的NaClO、NaHCO3混合溶液中,各种离子浓度关系正确的是( )
| A、c(Na+)>c(HCO3-)>c(H+)>c(OH-) |
| B、c(HCO3-)>c(ClO-)>c(OH-) |
| C、c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3) |
| D、c(Na+)+c(H+)=c(HCO3-)+c(ClO-)+c(OH-)+2c(CO32-) |
将足量CO2通入下列各溶液中,所含离子还能大量共存的是( )
| A、K+、SiO32-、Cl-、NO3- |
| B、H+、NH4+、Al3+、SO42- |
| C、Na+、S2-、OH-、SO42- |
| D、Na+、C6H5O-、CH3COO-、HCO3- |
下列关于胶体的叙述中不正确的是( )
| A、丁达尔现象可用来区别胶体与溶液 |
| B、胶体粒子能通过半透膜,不能通过滤纸 |
| C、胶体不稳定,在一定条件下会发生聚沉 |
| D、溶液、胶体、浊液的根本区别是分散质粒子直径的大小 |