题目内容
15.巴豆酸是一种对肠胃道有强烈刺激性、对呼吸中枢和心脏有麻痹作用的有机酸,其结构简式为CH3-CH=CH-COOH.根据巴豆酸结构特点,判断下列说法正确的是( )| A. | 巴豆酸能使溴的CCl4溶液褪色 | |
| B. | 巴豆酸不能使酸性KMnO4溶液褪色 | |
| C. | 1mol巴豆酸能与2molH2发生加成反应 | |
| D. | 巴豆酸能与CH3CH2OH发生取代反应 |
分析 由结构简式为CH3-CH=CH-COOH,可知含碳碳双键、-COOH,结合烯烃、羧酸的性质来解答.
解答 解:A.含碳碳双键,能使溴的CCl4溶液褪色,故A正确;
B.含碳碳双键,能使酸性KMnO4溶液褪色,故B错误;
C.只有碳碳双键与氢气发生加成反应,则1mol巴豆酸能与1molH2发生加成反应,故C错误;
D.含-COOH,能与CH3CH2OH发生酯化反应,属于取代反应,故D正确;
故选AD.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系、有机反应为解答的关键,侧重分析与应用能力的考查,注意烯烃、羧酸的性质,题目难度不大.

练习册系列答案
相关题目
1.X、Y、Z是3种原子序数逐渐增大的短周期元素,其中X、Y位于同一主族,X原子的最外层电子数是其电子层数的3倍.下列说法正确的是( )
| A. | 元素非金属性由弱到强的顺序为Z<Y<X | |
| B. | 化合物YZ2中各原子都达到8电子结构 | |
| C. | 这3种元素的氢化物的沸点由高到低的顺序为:Z>Y>X | |
| D. | 其对应的阴离子半径由大到小的顺序为:Z>Y>X |
6.下列有关NO2的说法正确的是( )
| A. | NO2可由N2与O2反应直接制备 | |
| B. | NO2有毒,但因其易溶于水且与水反应,因此不属于大气污染物 | |
| C. | NO2既有氧化性也有还原性 | |
| D. | NO2为红棕色气体,因此将NO2通入水中,溶液显红棕色 |
3.由氧气与氢气反应生成1摩尔液态水放出285.75KJ热量,下列热化学方程式书写正确的是( )
| A. | 2H2+O2=2H2O+285.75KJ | B. | 2H2(g)+O2 (g)=2H2O(l)+571.5KJ | ||
| C. | H2(g)+O2(g)=H2O(g)+285.75KJ | D. | H2 (g)+O2(g)=H2O(l)-285.75KJ |
10.下列关于 SO2 性质的说法中,不正确的是( )
| A. | 能KMnO4溶液褪色 | B. | 能使品红溶液褪色 | ||
| C. | 能与 NaOH 溶液反应 | D. | 能与水反应生成硫酸 |
7.在下列各溶液中,离子一定能大量共存的是( )
| A. | 强碱性溶液中:K+、Cu2+、Cl-、SO42- | |
| B. | 含有0.1 mol•L-1 Fe3+的溶液中:K+、Ba2+、OH-、NO3- | |
| C. | 含有0.1 mol•L-1 Ca2+酸溶液中:Na+、K+、CO32-、Cl- | |
| D. | 室温下,强酸性溶液中:Na+、Fe3+、NO3-、SO42- |
4.工业上常用二氧化硫来漂白纸浆、丝毛、草帽等,此外二氧化硫还能够抑制霉菌和细菌的滋生,可以用作食物和干果的防腐剂.但必须严格按照国家有关范围和标准使用,我国规定葡萄酒中SO2的最大使用量为0.25g/L.某化学兴趣小组制备并对SO2的化学性质和用途进行探究,探究过程实验装置如图,夹持仪器省略.
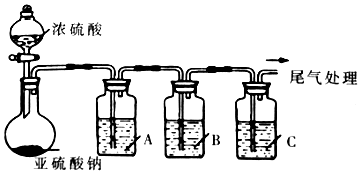
(1)实验可选用的实验试剂有浓硫酸、Na2SO3固体、Na2S溶液、BaCl2溶液、FeCl3溶液、品红溶液等.
①请完成下列表格
②A中发生反应的离子方程式为2Fe3++SO2+2H2O=2Fe2++4H++SO42-.
③在上述装置中通入过量的SO2,为了验证A中发生了氧化还原反应,取A中溶液分成两份,并设计了如下实验:
方案一:往第一份试液中加入少量酸化的KMnO4溶液,紫红色褪去.该方案是否合理否.(填“是”或“否”)
方案二:往第二份试液中加入K3[Fe(CN)6]溶液,实验现象为生成蓝色沉淀.
④该小组将SO2通入酸化的高锰酸钾溶液中,再向溶液中滴加氯化钡溶液,发现有白色沉淀生成,说明SO2具有还原性.该方案的不妥之处可能为高锰酸钾用硫酸酸化.
(2)该兴趣小组利用“直接碘量法”对葡萄酒中的SO2进行测量.取50.00ml葡萄酒样品于250mL碘量瓶中.加入少量碎冰块,再加入1mL淀粉指示液,10mL硫酸溶液,用浓度为cmol/L的碘标准滴定溶液迅速滴定至淡蓝色,保持30s不变即为终点,记下消耗碘标准滴定溶液的体积为VmL.以水代替样品,做空白试验,操作同上,空白试验消耗碘标准滴定溶液的体积为Voml.该葡萄酒中SO2含量计算式为$\frac{c(V-{V}_{0})×64}{50}$g/L.

(1)实验可选用的实验试剂有浓硫酸、Na2SO3固体、Na2S溶液、BaCl2溶液、FeCl3溶液、品红溶液等.
①请完成下列表格
| 试剂 | 作用 | |
| A | 验证SO2的还原性 | |
| B | Na2S溶液 | |
| C | 品红溶液 |
③在上述装置中通入过量的SO2,为了验证A中发生了氧化还原反应,取A中溶液分成两份,并设计了如下实验:
方案一:往第一份试液中加入少量酸化的KMnO4溶液,紫红色褪去.该方案是否合理否.(填“是”或“否”)
方案二:往第二份试液中加入K3[Fe(CN)6]溶液,实验现象为生成蓝色沉淀.
④该小组将SO2通入酸化的高锰酸钾溶液中,再向溶液中滴加氯化钡溶液,发现有白色沉淀生成,说明SO2具有还原性.该方案的不妥之处可能为高锰酸钾用硫酸酸化.
(2)该兴趣小组利用“直接碘量法”对葡萄酒中的SO2进行测量.取50.00ml葡萄酒样品于250mL碘量瓶中.加入少量碎冰块,再加入1mL淀粉指示液,10mL硫酸溶液,用浓度为cmol/L的碘标准滴定溶液迅速滴定至淡蓝色,保持30s不变即为终点,记下消耗碘标准滴定溶液的体积为VmL.以水代替样品,做空白试验,操作同上,空白试验消耗碘标准滴定溶液的体积为Voml.该葡萄酒中SO2含量计算式为$\frac{c(V-{V}_{0})×64}{50}$g/L.
5.点燃的镁条能在氨气中剧烈燃烧,发生如下反应:Mg+2NH3$\frac{\underline{\;点燃\;}}{\;}$Mg(NH2)2+H2,对该反应说法正确的是( )
| A. | NH3既是氧化剂又是还原剂 | B. | 氢元素既被氧化又被还原 | ||
| C. | 0.5mol氢气生成时转移1mol电子 | D. | 镁具有氧化性 |
