题目内容
12.纯碱溶液呈碱性的原因(用离子方程式表示)CO32-+H2O?HCO3-+OH-,HCO3-+H2O?H2CO3+OH-,纯碱溶液离子浓度由大到小的顺序为c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+).分析 Na2CO3是强碱弱酸盐,CO32-水解导致溶液呈碱性,碳酸根离子分不水解,据此分析判断离子浓度大小.
解答 解:Na2CO3是强碱弱酸盐,CO32-水解导致溶液呈碱性,水解离子方程式为:CO32-+H2O?HCO3-+OH-,HCO3-+H2O?H2CO3+OH-,溶液中离子浓度大小为:
c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+),
故答案为:CO32-+H2O?HCO3-+OH-,HCO3-+H2O?H2CO3+OH-;c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+).
点评 本题以离子浓度大小比较为载体考查盐类水解,为高频考点,明确盐类型及盐类水解特点是解本题关键,注意碳酸钠水解分步进行,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
20.按卤素原子核电荷数递增的顺序,下列各项变小或减弱的是( )
| A. | 原子半径 | B. | 简单离子的还原性 | ||
| C. | 单质的熔沸点 | D. | 氢化物的稳定性 |
7.某同学为了验证海带中含有碘,进行如下实验,请回答相关问题.
(1)第1步:灼烧,操作是将足量海带灼烧成灰烬,该过程中将用到的实验仪器除铁架台(有铁圈)、酒精灯、坩埚钳、泥三角外,还有B(填代号);
A.试管B.瓷坩埚C.蒸发皿D.烧杯
(2)第2步:含I-溶液的获取,其操作有溶解和过滤;
A.蒸馏B.分液C.过滤
(3)第3步:证明该溶液中含有I-,请你写出第二种不同的方法(试剂自选)
(1)第1步:灼烧,操作是将足量海带灼烧成灰烬,该过程中将用到的实验仪器除铁架台(有铁圈)、酒精灯、坩埚钳、泥三角外,还有B(填代号);
A.试管B.瓷坩埚C.蒸发皿D.烧杯
(2)第2步:含I-溶液的获取,其操作有溶解和过滤;
A.蒸馏B.分液C.过滤
(3)第3步:证明该溶液中含有I-,请你写出第二种不同的方法(试剂自选)
| 方法 | 选用试剂 | 现象 |
| 第一种(萃取) | 氯水、四氯化碳 | 下层溶液显紫色 |
| 第二种 |
17.下列离子方程式正确的是( )
| A. | NaAlO2溶液中通入过量的CO2:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- | |
| B. | FeCl2溶液中加入氯水:Cl2+Fe2+═Fe3++2Cl- | |
| C. | 碳酸氢钠与稀硫酸反应:CO32-+2H+═CO2↑+H2O | |
| D. | NaOH溶液与小苏打溶液反应 HCO3-+OH-═CO32-+H2O |
4.下列说法正确的是( )
①AlCl3溶液和Al2(SO4)3溶液加热蒸干,所得固体的成分相同
②配制FeCl3溶液时,将FeCl3固体溶解在硫酸中,然后再用水稀释到所需的浓度
③氟化铵溶液不能用玻璃瓶盛装
④泡沫灭火器中常使用的原料是碳酸钠和硫酸铝
⑤明矾可以做净水剂
⑥向碳酸钙中加入氯化铁溶液会产生气体,并能产生红褐色沉淀.
①AlCl3溶液和Al2(SO4)3溶液加热蒸干,所得固体的成分相同
②配制FeCl3溶液时,将FeCl3固体溶解在硫酸中,然后再用水稀释到所需的浓度
③氟化铵溶液不能用玻璃瓶盛装
④泡沫灭火器中常使用的原料是碳酸钠和硫酸铝
⑤明矾可以做净水剂
⑥向碳酸钙中加入氯化铁溶液会产生气体,并能产生红褐色沉淀.
| A. | ②③④⑤ | B. | ③⑤⑥ | C. | ①②③④⑤ | D. | ①②④⑥ |
2.下列各组物质反应,既有气体最终又有沉淀生成的是( )
①金属钠投入FeCl3溶液中 ②过量的NaOH溶液和明矾溶液
③Na2O2加到Ca(HCO3)2溶液中 ④浓硫酸铵溶液加入到浓氢氧化钡中.
①金属钠投入FeCl3溶液中 ②过量的NaOH溶液和明矾溶液
③Na2O2加到Ca(HCO3)2溶液中 ④浓硫酸铵溶液加入到浓氢氧化钡中.
| A. | ①④ | B. | ②③ | C. | ①②③ | D. | ①③④ |
3.氧化还原反应中,水的作用可以是氧化剂、还原剂、既是氧化剂又是还原剂、既非氧化剂又非还原剂等.下列反应与Br2+SO2+2H2O=H2SO4+2HBr相比较,水的作用不相同的是( )
| A. | 3NO2+H2O→2HNO3+NO | B. | 4Fe(OH)2+O2+2H2O→4Fe(OH)3 | ||
| C. | 2F2+2H2O→4HF+O2 | D. | 2H2O$\stackrel{通电}{→}$O2+2H2↑ |
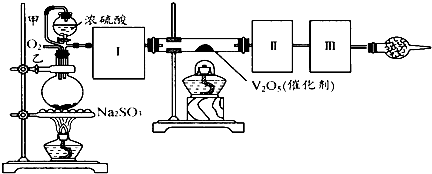

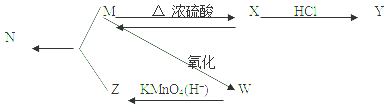
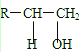 $→_{△}^{浓硫酸}$R-CH=CH2+H2O,叫做消去反应
$→_{△}^{浓硫酸}$R-CH=CH2+H2O,叫做消去反应