题目内容
14.写出下列反应的热化学方程式.(1)16g CH4(g)与适量O2(g)反应生成CO2(g)和H2O(l),放出890.3kJ热量CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3kJ•mol-1.
(2)1L 1mol•L-1KOH溶液中和1L 1mol•L-1HNO3溶液,放出57.3kJ热量KOH(aq)+HNO3(aq)═KNO3(aq)+H2O(l)△H=-57.3 kJ•mol-1.
(3)12g C(s)与适量O2(g)反应生成CO2(g),放出393.5kJ热量C(s)+O2(g)=CO2(g)△H=-393.5kJ•mol-1.
(4)氢气与碘蒸气反应,生成1mol碘化氢气体时,吸收25.59kJ热量I2(s)+H2(g)=2HI(g)△H=+51.18kJ/mol.
(5)1mol葡萄糖在人体中完全氧化,生成CO2(g)和H2O(l)产生2800kJ热量C6H12O6(s)+6O2(g)=6CO2(g)+6H2O(l)△H=-2800kJ•mol-1.
分析 (1)在25℃、101kPa下,16g甲烷(CH4)的物质的量为1mol,燃烧时消耗2mol氧气生成CO2和液态水时放热890.3kJ,书写热化学方程式时要标明物质的聚集状态;
(2)依据酸碱中和反应的定义要点和热化学方程式的书写原则得到,1L 1mol•L-1 KOH溶液中和1L 1mol•L-1 HNO3溶液恰好反应生成1mol水,反应放出的热量为中和热;(3)12g C(s)与适量O2(g)反应生成CO2(g),放出393.5kJ热量,也就是1mol的碳与氧气反应生成二氧化碳放393.5kJ,所以反应的热化学方程式为:C(s)+O2(g)=CO2(g)△H=-393.5kJ•mol-1,由此解答;
(4)1mol固态碘和 1mol氢气化合生成2mol碘化氢气体时,要吸收25.59kJ×2=51.18kJ热量,热化学方程式为:I2(s)+H2(g)=2HI(g)△H=+51.18kJ/mol,由此解答;
(5)1mol葡萄糖在人体中完全氧化,生成CO2(g)和H2O(l)产生2800kJ热量,所以萄糖燃烧的热化学方程式为:C6H12O6(s)+6O2(g)=6CO2(g)+6H2O(l)△H=-2800kJ•mol-1.
解答 解:(1)1mol甲烷完全燃烧生成二氧化碳和液态水放热890.3KJ;故燃烧的热化学方程式为:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3kJ•mol-1,
故答案为:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3kJ•mol-1;
(2)1L 1mol•L-1 KOH溶液中和1L 1mol•L-1 HNO3溶液,反应生成1mol水,放出57.3kJ热量,反应的热化学方程式为:KOH(aq)+HNO3(aq)═KNO3(aq)+H2O(l)△H=-57.3 kJ•mol-1 ,
故答案为:KOH(aq)+HNO3(aq)═KNO3(aq)+H2O(l)△H=-57.3 kJ•mol-1;
(3)12g C(s)与适量O2(g)反应生成CO2(g),放出393.5kJ热量,也就是1mol的碳与氧气反应生成二氧化碳放393.5kJ,所以反应的热化学方程式为:C(s)+O2(g)=CO2(g)△H=-393.5kJ•mol-1,故答案为:C(s)+O2(g)=CO2(g)△H=-393.5kJ•mol-1;
(4)1mol固态碘和 1mol氢气化合生成2mol碘化氢气体时,要吸收25.59kJ×2=51.18kJ热量,热化学方程式为:I2(s)+H2(g)=2HI(g)△H=+51.18kJ/mol,故答案为:I2(s)+H2(g)=2HI(g)△H=+51.18kJ/mol;
(5)1mol葡萄糖在人体中完全氧化,生成CO2(g)和H2O(l)产生2800kJ热量,所以萄糖燃烧的热化学方程式为:C6H12O6(s)+6O2(g)=6CO2(g)+6H2O(l)△H=-2800kJ•mol-1,故答案为:C6H12O6(s)+6O2(g)=6CO2(g)+6H2O(l)△H=-2800kJ•mol-1.
点评 本题考查热化学反应方程式的书写的相关知识,题目难度不大.应注意书写燃烧的热化学方程式和燃烧热的热化学方程式的区别.

 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案 小学期末标准试卷系列答案
小学期末标准试卷系列答案①AlCl3溶液和Al2(SO4)3溶液加热蒸干,所得固体的成分相同
②配制FeCl3溶液时,将FeCl3固体溶解在硫酸中,然后再用水稀释到所需的浓度
③氟化铵溶液不能用玻璃瓶盛装
④泡沫灭火器中常使用的原料是碳酸钠和硫酸铝
⑤明矾可以做净水剂
⑥向碳酸钙中加入氯化铁溶液会产生气体,并能产生红褐色沉淀.
| A. | ②③④⑤ | B. | ③⑤⑥ | C. | ①②③④⑤ | D. | ①②④⑥ |
①金属钠投入FeCl3溶液中 ②过量的NaOH溶液和明矾溶液
③Na2O2加到Ca(HCO3)2溶液中 ④浓硫酸铵溶液加入到浓氢氧化钡中.
| A. | ①④ | B. | ②③ | C. | ①②③ | D. | ①③④ |
| A. | 氯化钠的电子式: | B. | 碳原子电子式为 | ||
| C. | S2-的结构示意图: | D. | 氨气分子的结构式: |
| A. | 3NO2+H2O→2HNO3+NO | B. | 4Fe(OH)2+O2+2H2O→4Fe(OH)3 | ||
| C. | 2F2+2H2O→4HF+O2 | D. | 2H2O$\stackrel{通电}{→}$O2+2H2↑ |
| A. |  用装置制取氯气 | B. |  用装置除去氯气中的HCl | ||
| C. |  用装置收集一试管氯气 | D. | 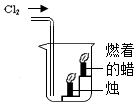 用装置验证氯气能支持 H2燃烧 |
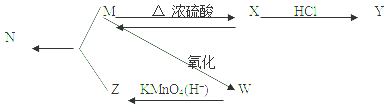
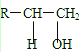 $→_{△}^{浓硫酸}$R-CH=CH2+H2O,叫做消去反应
$→_{△}^{浓硫酸}$R-CH=CH2+H2O,叫做消去反应


