��Ŀ����
2������������ݻ���Ϊ1L�ĺ��������У��ֱ����2molA��2molB��1molA��1molB����ͬ�����£��¶�T�棩���������з�Ӧ��A��g��+B��g��?xC��g����H��0�������������c��A����ʱ��t�ı仯��ͼ��ʾ��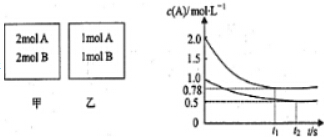
�ش��������⣺
��1���������У�ƽ�������B��ת��50%��
��2��x=1��
��3��T��ʱ�÷�Ӧ��ƽ������Ϊ2��
��4���������п����ж��Ѿ��ﵽƽ��ı�־��BD��
A��v��A��=c��C�� B��������ѹǿ����
C�������л��������ܶȲ��� D��������A������������䣮
��5������˵����ȷ����C��
A����ƽ�����������г��뺤����ʹc��A������
B�����������������¿�ʹ�������ڸ����ʵ�������������������ͬ
C��������������ٳ���2molA��2molB����ƽ��ʱ��������0.78mol•L-1��c��A����1.56mol•L-1
D����������Ϊ��ѹ�ɱ�����������г���������壬��c��A����С��ƽ�������ƶ���v��������v���棩��С��
���� ��1���������У�A�μӷ�Ӧ�����ʵ���=��1-0.5��mol/L��1L=0.5mol������A��B�Ĺ�ϵʽ֪���μӷ�Ӧ��B�����ʵ���Ҳ��0.5mol����B��ת����=$\frac{0.5mol/L}{1mol/L}$��100%��
��2������ס���������A��ת���ʣ��ٸ���ѹǿ��Aת���ʵ�Ӱ����ȷ��xֵ��
��3�����ݻ�ѧƽ�ⳣ��K=$\frac{c��C��}{c��A��•c��B��}$��
��4�����ݷ�Ӧ����ƽ��״̬�����淴Ӧ���ʣ�����ɳɷֲ��䣬��ijЩ��������������жϣ�
��5��A�����������У�A��Ũ�Ȳ��䣬��ƽ�ⲻ�ƶ���
B�������¶ȣ�ƽ�������ȷ�Ӧ�����ƶ���
C��������������ٳ���2molA��2molB���൱������ѹǿ��A��ת���ʱ�ԭ����
D����������Ϊ��ѹ�ɱ�����������г���������壬������������൱�ڼ�ѹ����c��A����С��v��������v���棩��С������ѹǿ��ƽ���ƶ���Ӱ����ж�ƽ���ƶ�����
��� �⣺��1���������У�A�μӷ�Ӧ�����ʵ���=��1-0.5��mol/L��1L=0.5mol������A��B�Ĺ�ϵʽ֪���μӷ�Ӧ��B�����ʵ���Ҳ��0.5mol����B��ת����=$\frac{0.5mol/L}{1mol/L}$��100%=50%��
�ʴ�Ϊ��50%��
��2����������Ӧ�ﵽƽ���c��A��=0.78 mol•L-1��A��ת����=$\frac{��2.0-0.78��mol/L}{2mol/L}$=61%���������У�A�μӷ�Ӧ�����ʵ���=��1-0.5��mol/L��1L=0.5mol��A��ת����=$\frac{0.5mol/L}{1mol/L}$=50%����ѹǿԽ��A��ת����Խ�ߣ���������ӦΪ���������С�ķ�Ӧ����x=1��
�ʴ�Ϊ��1��
��3����Ӧ�ﵽƽ��ʱ����������c��A��=c��B��=c��C��=0.5 mol•L-1��T��ʱ���÷�Ӧ��ƽ�ⳣ��K=$\frac{c��C��}{c��A��•c��B��}$=$\frac{0.5}{0.5��0.5}$=2��
�ʴ�Ϊ��2��
��4��A��v��A��=c��C����δ˵��������Ӧ���ʻ����淴Ӧ���ʣ��ʲ����жϷ�Ӧ�Ƿ���ƽ��״̬����A����
B���÷�ӦΪ���������С�ķ�Ӧ��������ѹǿ����ʱ��˵����Ӧ�Ѿ�����ƽ��״̬����B��ȷ��
C���÷�Ӧ�Ǻ��������½��У���Ӧ�����������غ㣬���������л��������ܶ�ʼ�ղ��䣬���ܶȲ�����Ϊƽ��״̬ ���ж����ݣ���C����
D��������A������������䣬��˵����Ӧ����ƽ��״̬����D��ȷ��
��ѡBD��
��5��A����ƽ�����������г���������庤���������Ũ�Ȳ��䣬ƽ�ⲻ�����ƶ�������c��A�����䣬��A����
B�����������������£�ƽ�������ƶ���A����������������ڼ�������A�������������B����
C��������������ٳ���2 mol A��2 mol B���൱������ѹǿ��ƽ��������Ӧ�����ƶ�����ﵽƽ��ʱA��ת���ʱȲ���ǰ��������ƽ��ʱ��������0.78 mol•L-1��c��A����1.56 mol•L-1����C��ȷ��
D����������Ϊ��ѹ�ɱ�����������г���������壬������������൱�ڼ�ѹ����c��A����С��v��������v���棩��С���÷�Ӧ������ӦΪ���������С�ķ�Ӧ����ѹƽ�������ƶ�����D����
�ʴ�Ϊ��C��
���� ���⿼���˻�ѧƽ����ƶ�����ѧƽ��ļ��㡢��Чƽ���֪ʶ�㣬����ͼ�����ת���ʣ�����ת���ʼ���xֵ���ٽ�ϵ�Чƽ�⼰Ӱ�컯ѧƽ���������������4����ע���Чƽ���Ӧ�ã��Ѷ��еȣ�

 ����С����ͬ������ϵ�д�
����С����ͬ������ϵ�д�| A�� | 9 mol | B�� | 7 mol | C�� | 6 mol | D�� | 8 mol |
H2O��g���TH2��g��+$\frac{1}{2}$O2��g����H=+241.8kJ/mol
H2��g��+$\frac{1}{2}$O2��g���TH2O��1����H=-285.8kJ/mol
��1gҺ̬ˮ��Ϊˮ����ʱ���������仯�ǣ�������
| A�� | ����44kJ | B�� | ����2.44KJ | C�� | ����44kJ | D�� | ����2.44KJ |
| A�� | ����������õİ뵼����� | |
| B�� | ���ά�гɷֺ�ɳ���е���Ҫ�ɷ���ͬ | |
| C�� | ��ͨ�����ʯ��ˮ�ķ����������ֳ�CO2��SO2���� | |
| D�� | SO2��Ư��ԭ����ľ̿���������Ƽ�ʪ��������Ư��ԭ����ͬ |
| A�� | ������ˮ�м�ˮϡ�ͣ��ٽ���ˮ��ˮ�ĵ��� | |
| B�� | ��ˮ�м����Ȼ�泥������Ȼ����Һ�����ԣ�������ҺpH���� | |
| C�� | ̼������Һ�д���CO32-+H2O?HCO3-+OH-ƽ�⣬��ͨ��CO2����ƽ�������ƶ� | |
| D�� | ��������þ����Һ�м�ˮϡ�ͣ�Mg��OH��2�����ܽ�ƽ�������ƶ�����c��Mg2+������ |
����ͭ��������ʷ��ʹ������ĺϽ�
�ںϽ���۵�һ��ȸ��ɷֽ����۵�ߣ�
�ۺϽ������ȴ����Ľ����нϺõ���������ѧ���е����
�ܺϽ�������Ǹ��ɷֽ�������֮�͢�����������������Ũ���ᡢŨ���ᣮ
| A�� | �٢ۢܢ� | B�� | �٢ۢ� | C�� | �٢ڢ� | D�� | �٢ڢۢܢ� |
| A�� | ʹ���ȱ�����Һ�У�Na+��Cl-��CH3COO-��Fe2+ | |
| B�� | ˮ�����OH-Ũ��Ϊ10-12mol/L-1����Һ�У�Mg2+��NH4+��AlO2-��SO32- | |
| C�� | ��ɫ��Һ�У�Al3+��NO3-��Cl-��SO42- | |
| D�� | c��H2C2O4��=0.5 mol/L��Һ�У�Na+��K+��MnO4-��Cl- |