题目内容
14.下列物质中的杂质(括号中是杂质)分别可以用什么方法除去.混合物分离常用的操作有哪些?(1)NaCl(泥沙) (2)壬烷(己烷) (3)KNO3(NaCl) (4)乙酸乙酯(乙酸)
(5)甲烷(乙烯) (6)酒精(水)
分析 (1)泥沙不溶于水;
(2)壬烷、己烷互溶,但沸点不同;
(3)KNO3、NaCl的溶解度受温度影响不同;
(4)乙酸与碳酸钠反应后,与乙酸乙酯分层;
(5)乙烯与溴水反应,而甲烷不能;
(6)CaO与水反应后,增大与酒精的沸点差异.
解答 解:(1)泥沙不溶于水,利用过滤法分离;
(2)壬烷、己烷互溶,但沸点不同,选择蒸馏法分离;
(3)KNO3、NaCl的溶解度受温度影响不同,选择结晶法分离;
(4)乙酸与碳酸钠反应后,与乙酸乙酯分层,则加碳酸钠溶液、分液分离;
(5)乙烯与溴水反应,而甲烷不能,则利用溴水、洗气分离;
(6)CaO与水反应后,增大与酒精的沸点差异,则加CaO后蒸馏分离,
答:(1)~(6)的分离方法分别为过滤、蒸馏、结晶、分液、洗气、蒸馏.
点评 本题考查混合物分离提纯的方法及选择,为高频考点,把握物质的性质、性质差异及混合物分离原理为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
4.下列有关硅及其化合物的叙述中,正确的是( )
| A. | SiO2不溶于水,也不溶于酸和碱 | B. | SiO2是制造太阳能电池的常用材料 | ||
| C. | 硅是地壳中含量最多的非金属元素 | D. | 水玻璃可用作木材防火剂 |
5.从人类生存的环境考虑,未来理想的燃料应是( )
| A. | 煤 | B. | 氢气 | C. | 石油炼制品 | D. | 酒精 |
9.下列离子方程式书写正确的是( )
| A. | 0.5mol•L-1的NaHSO3溶液与1.0mol•L-1的NaClO溶液等体积混合:HSO3-+ClO-═SO42-+Cl-+H+ | |
| B. | 向Ca(HCO3)2溶液中加入足量的澄清石灰水:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O | |
| C. | 氢氧化铁溶于氢碘酸中:2Fe(OH)3+6H++2I-═2Fe2++I2+6H2O | |
| D. | H218O中投入Na2O2固体:2H218O+2Na2O2═4OH-+4Na++18O2↑ |
19.下列说法正确的是( )
| A. | 使用容量瓶、量筒、滴定管等仪器时,先用水洗后还需待装液润洗 | |
| B. | 洗涤沉淀的操作是将沉淀置于滤纸上(已放置在漏斗中),边用玻璃棒搅拌边加蒸馏水冲洗 | |
| C. | 为提升燃料电池的效率,通常可以用KNO3代替蒸馏水,同时作电极的碳棒先灼烧,然后投入到冷水中,反复3-5次 | |
| D. | 在制取乙酸乙酯的实验中,收集乙酸乙酯的试管中加的是饱和Na2CO3溶液,而且导管直接插入到饱和Na2CO3溶液 |
19.1923年以前,甲醇一般是用木材或其废料的分解蒸馏来生产的.现在工业上合成甲醇几乎全部采用一氧化碳或二氧化碳加压催化加氢的方法,工艺过程包括造气、合成净化、甲醇合成和粗甲醇精馏等工序.
已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
(1)反应②是吸热(填“吸热”或“放热”)反应.
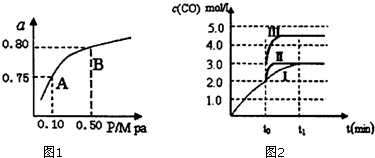
(2)某温度下反应①中H2的平衡转化率(a)与体系总压强(P)的关系如图1所示.则平衡状态由A变到B时,平衡常数K(A)=K(B)(填“>”、“<”或“=”).据反应①与②可推导出K1、K2与K3之间的关系,则K3=K1×K2(用K1、K2表示).
(3)在3L容积可变的密闭容器中发生反应②,已知c(CO)与反应时间t变化曲线Ⅰ如图2所示,若在t0时刻分别改变一个条件,则曲线Ⅰ可变为曲线Ⅱ和曲线Ⅲ.当曲线Ⅰ变为曲线Ⅱ时,改变的条件是加入催化剂.当曲线Ⅰ变为曲线Ⅲ时,改变的条件是将容器的体积(快速)压缩至2L.
(4)甲醇燃料电池有着广泛的用途,若采用铂为电极材料,两极上分别通入甲醇和氧气,以氢氧化钾溶液为电解质溶液,则该碱性燃料电池的负极反应式是CH3OH-6 e-+8 OH-=CO32-+6 H2O;
已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
| 化学反应 | 平衡常数 | 温度℃ | |
| 500 | 800 | ||
| ①2H2(g)+CO(g)?CH3OH(g) | K1 | 2.5 | 0.15 |
| ②H2(g)+CO2(g)?H2O(g)+CO(g) | K2 | 1.0 | 2.50 |
| ③3H2(g)+CO2(g)?CH3OH(g)+H2O(g) | K3 | ||
(2)某温度下反应①中H2的平衡转化率(a)与体系总压强(P)的关系如图1所示.则平衡状态由A变到B时,平衡常数K(A)=K(B)(填“>”、“<”或“=”).据反应①与②可推导出K1、K2与K3之间的关系,则K3=K1×K2(用K1、K2表示).
(3)在3L容积可变的密闭容器中发生反应②,已知c(CO)与反应时间t变化曲线Ⅰ如图2所示,若在t0时刻分别改变一个条件,则曲线Ⅰ可变为曲线Ⅱ和曲线Ⅲ.当曲线Ⅰ变为曲线Ⅱ时,改变的条件是加入催化剂.当曲线Ⅰ变为曲线Ⅲ时,改变的条件是将容器的体积(快速)压缩至2L.
(4)甲醇燃料电池有着广泛的用途,若采用铂为电极材料,两极上分别通入甲醇和氧气,以氢氧化钾溶液为电解质溶液,则该碱性燃料电池的负极反应式是CH3OH-6 e-+8 OH-=CO32-+6 H2O;

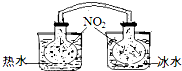 (1)已知:2NO2 ?N2O4(g)△H<0.如图所示,放入热水中的NO2球产生的现象为红棕色变深
(1)已知:2NO2 ?N2O4(g)△H<0.如图所示,放入热水中的NO2球产生的现象为红棕色变深