题目内容
5.实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验.请你完成下列填空:步骤一:配制250mL 0.1000mol/L NaOH标准溶液.
步骤二:取20.00mL待测稀盐酸放入锥形瓶中,并滴加2~3滴酚酞溶液作指示剂,用自己配制的标准NaOH溶液进行滴定.重复上述滴定操作4次,记录数据如表.
| 实验编号 | NaOH溶液的浓度 (mol/L) | 滴定完成时,消耗NaOH溶液的体积(mL) | 待测盐酸溶液的体积(mL) |
| 1 | 0.10 | 20.02 | 20.00 |
| 2 | 0.10 | 20.00 | 20.00 |
| 3 | 0.10 | 19.98 | 20.00 |
(2)步骤二中量取20.00mL的稀盐酸用到的仪器是酸式滴定管.判断滴定终点的现象是最后一滴NaOH溶液加入时,溶液颜色恰好由无色变为(浅)红色,且半分钟内不褪色.
(3)根据上述数据,可计算出该盐酸的浓度为0.10mol/L.
(4)在上述实验中,下列操作(其他操作正确)会造成测定结果(待测液浓度值)偏高的有ADE
A.配制标准溶液定容时,加水超过刻度
B.锥形瓶水洗后直接装待测液
C.酸式滴定管水洗后未用待测稀盐酸溶液润洗
D.滴定到达终点时,仰视读出滴定管读数;
E.碱式滴定管尖嘴部分有气泡,滴定后消失.
分析 (1)结合m=cVM计算;在烧杯中溶解、冷却后转移到容量瓶中定容;
(2)量取20.00mL的稀盐酸,选择酸式滴定管,NaOH滴定盐酸,选择酚酞为指示剂,开始为无色,滴定终点为红色;
(3)由数据可知,消耗NaOH的体积为$\frac{20.02mL+20.00mL+19.98mL}{3}$=20.00mL,结合n(HCl)=n(NaOH)计算.
(4)由c(盐酸)=$\frac{c(NaOH)V(NaOH)}{V(盐酸)}$可知,不当操作使V(NaOH)偏大,则会造成测定结果偏高.
解答 解:(1)步骤一需要称量氢氧化钠固体的质量为0.25L×0.1mol/L×40g/mol=1.0g;在烧杯中溶解、冷却后转移到容量瓶中定容,还需要仪器为250mL容量瓶,胶头滴管,故答案为:1.0;250mL容量瓶,胶头滴管;
(2)步骤二中量取20.00mL的稀盐酸用到的仪器是酸式滴定管.判断滴定终点的现象是最后一滴NaOH溶液加入时,溶液颜色恰好由无色变为(浅)红色,且半分钟内不褪色,
故答案为:酸式滴定管;最后一滴NaOH溶液加入时,溶液颜色恰好由无色变为(浅)红色,且半分钟内不褪色;
(3)由数据可知,消耗NaOH的体积为$\frac{20.02mL+20.00mL+19.98mL}{3}$=20.00mL,c(盐酸)=$\frac{0.02L×0.1mol/L}{0.02L}$=0.10mol/L,
故答案为:0.10mol/L;
(4)A.配制标准溶液定容时,加水超过刻度,c(NaOH)偏小,消耗的V(NaOH)偏大,由c(盐酸)=$\frac{c(NaOH)V(NaOH)}{V(盐酸)}$可知,会造成测定结果偏高,故A选;
B.锥形瓶水洗后直接装待测液,对实验无影响,故B不选;
C.酸式滴定管水洗后未用待测稀盐酸溶液润洗,n(HCl)偏小,V(NaOH)偏小,由c(盐酸)=$\frac{c(NaOH)V(NaOH)}{V(盐酸)}$可知,会造成测定结果偏低,故C不选;
D.滴定到达终点时,仰视读出滴定管读数,耗V(NaOH)偏大,由c(盐酸)=$\frac{c(NaOH)V(NaOH)}{V(盐酸)}$可知,会造成测定结果偏高,故D选;
E.碱式滴定管尖嘴部分有气泡,滴定后消失,V(NaOH)偏大,由c(盐酸)=$\frac{c(NaOH)V(NaOH)}{V(盐酸)}$可知,会造成测定结果偏高,故E选;
故答案为:ADE.
点评 本题考查中和滴定实验,为高频考点,把握仪器的使用、滴定原理、数据处理及误差分析为解答的关键,侧重分析与实验能力的考查,注意结合计算式分析误差,题目难度不大.

(1)现有一瓶A和B的混合液,已知它们的性质如表.
| 物质 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | 溶解性 |
| A | -11.5 | 198 | 1.11 | A、B互溶,且均易溶于水 |
| B | 17.9 | 290 | 1.26 |
(2)有下列物质:①铜;②硫酸钡;③NaHCO3固体;④稀硫酸;⑤熔融硝酸钾;⑥乙醇;⑦液态氯化氢;⑧金刚石;⑨二氧化硫;⑩醋酸.其中属于电解质的有②③⑤⑦⑩;写出物质③在水溶液中的电离方程式:NaHCO3═Na++HCO3-
(3)已知反应①2FeCl3+2HI=2FeCl2+2HCl+I2;②H2SO3+I2+H2O=2HI+H2SO4则HI、FeCl2、H2SO3 三种物质的还原性由强到弱的顺序为H2SO3>HI>FeCl2.
(4)一定条件下,XO3n-与I-发生反应的离子方程式为:XO3n-+6I-+6H+═X-+3I2+3H2O,试推断XO3n-中X元素的化合价为+5,n的数值为1.


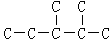 ,此烷烃的一溴代物有6种;若此烷烃由炔烃加氢制得,则此炔烃的结构简式为(CH3)2CH(CH3)CHC≡CH
,此烷烃的一溴代物有6种;若此烷烃由炔烃加氢制得,则此炔烃的结构简式为(CH3)2CH(CH3)CHC≡CH