题目内容
1.生产生活中广泛涉及氧化还原反应.(1)工业上冶炼下列物质通常不采用电解法的是cd.
a.Na b.Mg c.Fe d.Ag
(2)图1为电解精炼铜的示意图,电极a为粗铜,则a连接电源的正极,b极的电极反应式为Cu2++2e-=Cu.
(3)某小组按图2所示的装置探究铁的腐蚀.

完成下列填空:
①图2为电化学腐蚀类型中的吸氧腐蚀.图3是图2所示装置的示意图,在图3的小括号内填写正极材料的化学式;在方括号内用箭头表示出电子流动的方向.
②写出正极的电极反应式2H2O+O2+4e-=4OH-.
③按图2装置实验,约8分钟才看到的导管中液柱上升,下列措施可以更快更清晰地观察到液柱上升的是abc.
a.用纯氧气代替具支试管内的空气
b.用食盐水浸泡过的铁钉再蘸取铁粉和炭粉的混合物
c.用毛细尖嘴管代替玻璃导管,并向试管的水中滴加少量红墨水.
分析 (1)电解法:冶炼活泼金属K、Ca、Na、Mg、Al,热还原法:冶炼较不活泼的金属Zn、Fe、Sn、Pb、Cu,热分解法:Hg、Ag;
(2)精炼铜时,粗铜为阳极,纯铜为阴极;
(3)①铁打所处环境为中性,铁钉发生的是吸氧腐蚀,碳作正极,铁作负极,电子从负极沿导线流向正极;
②负极上铁失电子发生氧化反应,正极上氧气得电子发生还原反应;
③要使现象更快、更清晰,可采取增大反应速率等方法.
解答 解:(1)Na、Mg常用电解法冶炼,Fe用热还原法冶炼,Ag用热分解法冶炼,
故答案为:cd;
(2)精炼铜时,粗铜为阳极,纯铜为阴极,则a为阳极,连接电源正极,b为阴极,发生还原反应,电极方程式为Cu2++2e-=Cu,
故答案为:正;Cu2++2e-=Cu;
(3)①铁打所处环境为中性,铁钉发生的是吸氧腐蚀,碳作正极,铁作负极,电子从负极沿导线流向正极,其图象为:
故答案为:吸氧腐蚀; ;
;
②负极上铁失电子发生氧化反应,正极上氧气得电子发生还原反应,电极反应为:2H2O+O2+4e-=4OH-;
故答案为:2H2O+O2+4e-=4OH-;
③要使现象更快、更清晰,可采取增大反应速率等方法:
a.用纯氧气代替具支试管内的空气,氧气的浓度增大,反应速率加快,故a正确;
b.用食盐水浸泡过的铁钉再蘸取铁粉和炭粉的混合物,增大反应物的接触面积,反应速率加快,故b正确;
c.用毛细尖嘴管代替玻璃导管,并向试管的水中滴加少量红墨水,改变相同的压强即改变相同的体积,毛细尖嘴管上升的高度大于玻璃导管,且红墨水现象更明显,故正c确;
故答案为:abc.
点评 本题考查较为综合,涉及金属的冶炼、电解以及氧化还原反应等知识,为高频考点,侧重于学生的分析能力的考查,注意金属的吸氧腐蚀,明确吸氧腐蚀的原理是解本题关键,知道影响反应速率的因素,难度不大.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 乙酸 | B. | 甲烷 | C. | 苯酚 | D. | 乙醇 |
| A. | 氨气极易溶于水,可用作制冷剂 | |
| B. | 乙醇燃烧时放出热量,可用作燃料 | |
| C. | 碳酸氢钠能与盐酸反应,用作治疗胃酸过多 | |
| D. | 葡萄糖能与银氨溶液反应,可用作制镜 |
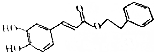 咖啡酸苯乙酯是蜂胶的主要成分,因具有极强的抗炎和抗氧化活性得以在食品、医学以及其他领城广泛应用,其分子结构简式如图.下列关于咖啡酸苯乙酯的说法不正确的是( )
咖啡酸苯乙酯是蜂胶的主要成分,因具有极强的抗炎和抗氧化活性得以在食品、医学以及其他领城广泛应用,其分子结构简式如图.下列关于咖啡酸苯乙酯的说法不正确的是( )| A. | 咖啡酸苯乙酯的分子式为C17H16O4 | |
| B. | 咖啡酸苯乙酯可以发生水解、取代、消去反应 | |
| C. | 1mol咖啡酸苯乙酯最多可与7mol H2反应 | |
| D. | 1mol咖啡酸苯乙酯最多可与4mol Br2反应 |
| A. | 物质的量浓度 | B. | 溶解度 | C. | 质量分数 | D. | 摩尔质量 |
| A. | 元素X的简单气态氢化物的热稳定性比W的弱 | |
| B. | 元素W的最高价氧化物对应水化物的酸性比Z的弱 | |
| C. | 化合物YX、ZX2、WX3中化学键的类型相同 | |
| D. | 原子半径的大小顺序:rY>rZ>rW>rX |
| A. | 34g质量分数为4%的H2O2水溶液中含氧原子数目为0.08NA | |
| B. | 反应3H2(g)+N2(g)═2NH3(g)△H=-92kJ/mol,若放出热量4.6kJ,则转移电子数目为0.3NA | |
| C. | 常温常压下,28g乙烯与丙烯的混合气体中含有的碳原子数目无法计算 | |
| D. | 6.4gCu与40mL10mol•L-1浓硝酸作用能生成NO2的分子数为0.2NA |
| A. | 甲基电子式 | B. | 四氯化碳比例模型 | ||
| C. | 甲酸甲酯分子式C2H4O2 | D. | 34S2-结构示意图 |