题目内容
10.设NA为阿伏加罗常数的值,下列说法正确的是( )| A. | 34g质量分数为4%的H2O2水溶液中含氧原子数目为0.08NA | |
| B. | 反应3H2(g)+N2(g)═2NH3(g)△H=-92kJ/mol,若放出热量4.6kJ,则转移电子数目为0.3NA | |
| C. | 常温常压下,28g乙烯与丙烯的混合气体中含有的碳原子数目无法计算 | |
| D. | 6.4gCu与40mL10mol•L-1浓硝酸作用能生成NO2的分子数为0.2NA |
分析 A.双氧水溶液中,水分子中也含有氧原子;
B.根据放出热量计算出消耗氮气的物质的量,然后根据化合价变化计算出转移电子的数目;
C.乙烯和丙烯的最简式均为CH2;
D.浓硝酸随着反应的进行,逐渐变为稀硝酸,铜与稀硝酸反应生成的是NO.
解答 解;A.双氧水溶液中,水分子中也含有氧原子,所以34g质量分数为4%的H2O2水溶液中含氧原子数目远远大于0.08NA,故A错误;
B.放出4.6kJ热量消耗氮气的物质的量为:$\frac{4.6KJ}{92KJ/mol}$=0.05mol,则转移电子的物质的量为:0.05mol×[0-(-3)]×2=0.3mol,则转移电子数目为0.3NA,故B正确;
C.乙烯和丙烯的最简式均为CH2,故28g混合物中含有的CH2的物质的量为2mol,则含2NA个碳原子,故C错误;
D.40mL10mol•L-1浓硝酸中含有硝酸的物质的量为0.4mol,6.4g铜的物质的量为0.1mol,0.1mol铜完全反应消耗浓硝酸0.4mol,而浓硝酸随着反应的进行,逐渐变为稀硝酸,故6.4 gCu不能完全反应生成NO2,还有部分生成NO,故D错误;
故选:B.
点评 本题考查了阿伏伽德罗常数的综合应用,明确物质的量与阿伏伽德罗常数、摩尔质量、物质的量浓度之间的关系为解答关键,注意烯烃结构特点,注意铜与浓硝酸反应产物与硝酸浓度之间的关系,题目难度中等.

练习册系列答案
相关题目
5. 常温下,在0.2mol/LAlCl3溶液中,逐滴加入1.0mol/LNaOH溶液,实验测得溶液pH随NaOH溶液体积变化曲线如图,下列有关说法正确的( )
常温下,在0.2mol/LAlCl3溶液中,逐滴加入1.0mol/LNaOH溶液,实验测得溶液pH随NaOH溶液体积变化曲线如图,下列有关说法正确的( )
 常温下,在0.2mol/LAlCl3溶液中,逐滴加入1.0mol/LNaOH溶液,实验测得溶液pH随NaOH溶液体积变化曲线如图,下列有关说法正确的( )
常温下,在0.2mol/LAlCl3溶液中,逐滴加入1.0mol/LNaOH溶液,实验测得溶液pH随NaOH溶液体积变化曲线如图,下列有关说法正确的( )| A. | a 点时,溶液呈酸性的原因是Al3+水解,离子方程式为:Al3++3OH-═Al(OH)3 | |
| B. | b点水的电离程度小于a 点 | |
| C. | 通过曲线变化,可估计Al(OH)3的溶度积约为1×10-20 | |
| D. | d点时,溶液中已无沉淀剩余 |
15.盐酸、醋酸、碳酸钠和碳酸氢钠是生活中常见的物质,下列表述正确的是( )
| A. | NaHCO3溶液中存在:c(OH-)═c (H+)+c (H2CO3) | |
| B. | 25℃时,将pH=2的盐酸与pH=12的氨水混合后,溶液呈中性,则消耗溶液的体积:V(盐酸)<V(氨水) | |
| C. | pH相等的盐酸和CH3COOH溶液稀释到相同的pH,盐酸稀释的倍数大 | |
| D. | 将0.2mol/L的NaHCO3溶液和0.1mol/L的醋酸钠溶液等体积混合,溶液中存在:c(Na+)═c(CH3COOH)+c(CH3COO-)+c(CO32-)+c(HCO3-)+c(H2CO3) |
2.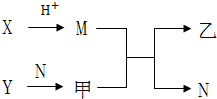 已知A、B、C、D为短周期内原子半径依次增大的元素,X、Y、M、N分别由这四种元素中的两种组成的常见化合物,甲、乙为其中两种元素对应的单质.若X与Y、甲与乙摩尔质量相同,Y与乙均为淡黄色固体,上述物质之间的转化关系如图所示(部分反应物或生成物省略),则下列说法中不正确的是( )
已知A、B、C、D为短周期内原子半径依次增大的元素,X、Y、M、N分别由这四种元素中的两种组成的常见化合物,甲、乙为其中两种元素对应的单质.若X与Y、甲与乙摩尔质量相同,Y与乙均为淡黄色固体,上述物质之间的转化关系如图所示(部分反应物或生成物省略),则下列说法中不正确的是( )
 已知A、B、C、D为短周期内原子半径依次增大的元素,X、Y、M、N分别由这四种元素中的两种组成的常见化合物,甲、乙为其中两种元素对应的单质.若X与Y、甲与乙摩尔质量相同,Y与乙均为淡黄色固体,上述物质之间的转化关系如图所示(部分反应物或生成物省略),则下列说法中不正确的是( )
已知A、B、C、D为短周期内原子半径依次增大的元素,X、Y、M、N分别由这四种元素中的两种组成的常见化合物,甲、乙为其中两种元素对应的单质.若X与Y、甲与乙摩尔质量相同,Y与乙均为淡黄色固体,上述物质之间的转化关系如图所示(部分反应物或生成物省略),则下列说法中不正确的是( )| A. | A、C、D的常见氧化物相互之间一定能反应 | |
| B. | 相对分子质量M>N,沸点N>M | |
| C. | 简单离子半径:C2->B2->D+>A+ | |
| D. | D与其他元素均能形成离子化合物 |
19.下列有关物质结构的说法正确的是( )
| A. | 电子层数多的原子的半径一定大于电子层数少的原子的半径 | |
| B. | P4S3分子中各原子的最外层均已达到了8电子稳定结构,则分子中共价键数目为9条 | |
| C. | H2SO3酸性强于H2CO3,所以非金属性S大于C | |
| D. | 不同原子形成的化合物中一定只含极性键 |
20.下列表示对应化学反应的离子方程式正确的是( )
| A. | Fe(OH)3胶体的制备:Fe3++3NH3•H2O═Fe(OH)3(胶体)+3NH4+ | |
| B. | 等物质的量的MgCl2、Ba(OH)2和HCl溶液混合:Mg2++2OH-═Mg(OH)2↓ | |
| C. | 铅酸蓄电池充电时的阳极反应:PbSO4+2H2O-2e-═PbO2+4H++SO42- | |
| D. | 用过量氨水吸收工业尾气中的SO2:NH3•H2O+SO2═NH4++HSO3- |
