题目内容
18.(1)1.5molH2SO4质量是147克,其中含有3摩尔氢原子,含有96克氧原子;(2)9.03×1023个氨分子含1.5mol氨分子,4.5mol氢原子.
分析 (1)根据m=nM计算出硫酸的质量;根据硫酸的分子式可计算出含有氢离子、氧原子的物质的量,最后根据m=nM计算出含有氧原子的质量;
(2)根据n=$\frac{N}{{N}_{A}}$计算出氨气分子的物质的量,然后根据氨气的分子式计算出含有氢离子的物质的量.
解答 解:(1)1.5molH2SO4质量是:98g/mol×1.5mol=147g;1.5mol硫酸分子中含有氢离子的物质的量为:1.5mol×2=3mol,含有氧原子的物质的量为:1.5mol×4=6mol,含有氧原子的质量为:16g/mol×6mol=96g,
故答案为:147;3;96;
(2)9.03×1023个氨分子含氨气分子的物质的量为:$\frac{9.03×1{0}^{23}}{6.02×1{0}^{23}}$=1.5mol,1.5mol氨气分子中含有氢离子的物质的量为:1.5mol×3=4.5mol,
故答案为:1.5;4.5.
点评 本题考查了物质的量的计算,题目难度中等,明确物质的量与摩尔质量、阿伏伽德罗常数之间的关系为解答关键,试题培养了学生的化学计算能力.

练习册系列答案
相关题目
8.在元素周期表中位于金属和非金属元素的交界处,容易找到的元素是( )
| A. | 制备催化剂的元素 | B. | 耐高温的合金元素 | ||
| C. | 用于半导体材料的元素 | D. | 制备农药的元素 |
13.下列各组中两个变化所发生的反应,属于同一类型的是( )
| A. | 由氯乙烷制乙烯、由溴乙烷制乙醇 | |
| B. | 乙烯使溴的CCl4溶液褪色、甲苯使酸性高锰酸钾水溶液褪色 | |
| C. | 由HO-CH2-COOH制 、由氯乙烯制聚氯乙烯 、由氯乙烯制聚氯乙烯 | |
| D. | 由苯制硝基苯、由乙醇制取乙酸乙酯 |
3.下列有关实验的操作和设计正确的是( )
| A. | 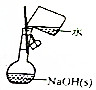 配制0.10mol•L-1的NaOH溶液 配制0.10mol•L-1的NaOH溶液 | |
| B. | 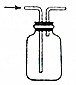 在实验室中用排空气法收集CO2 在实验室中用排空气法收集CO2 | |
| C. | 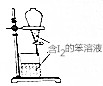 用苯萃取碘水中的碘,分出水层后的操作 用苯萃取碘水中的碘,分出水层后的操作 | |
| D. | 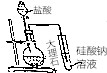 比较Cl,C,Si三种元素的非金属性强弱 比较Cl,C,Si三种元素的非金属性强弱 |
19.下列有关物质结构的说法正确的是( )
| A. | 电子层数多的原子的半径一定大于电子层数少的原子的半径 | |
| B. | P4S3分子中各原子的最外层均已达到了8电子稳定结构,则分子中共价键数目为9条 | |
| C. | H2SO3酸性强于H2CO3,所以非金属性S大于C | |
| D. | 不同原子形成的化合物中一定只含极性键 |
