��Ŀ����
��1�������¶���a mL pH=13NaOH��Һ��b mL0.05mol/L H2SO4��ϣ����û����Һ��pH=7����a��b=
��2�����ں�������AgCl����ı���AgCl��Һ�зֱ���룺A��100mL����ˮ�У�B��100mL 0.2mol?L-1AgNO3��Һ�У�C��100mL 0.1mol?L-1AlCl3��Һ�У�D��100mL 0.1mol?L-1������Һ�У���ֽ����������Ũ����С���� ������ţ�
��3����25���£���Ũ�Ⱦ�Ϊ0.20mol?L-1��MgCl2��CuCl2�����Һ����μ��백ˮ��������
�������ѧʽ�������ɸó��������ӷ���ʽΪ ���������ҺpH=11.00ʱ������¶��²�������Һ�е�c��Mg2+����c��Cu2+��= ������֪25��ʱKsp[Mg��OH��2]=1.8��10-11��KsP[Cu��OH��2]=2.0��10-20��
��2�����ں�������AgCl����ı���AgCl��Һ�зֱ���룺A��100mL����ˮ�У�B��100mL 0.2mol?L-1AgNO3��Һ�У�C��100mL 0.1mol?L-1AlCl3��Һ�У�D��100mL 0.1mol?L-1������Һ�У���ֽ����������Ũ����С����
��3����25���£���Ũ�Ⱦ�Ϊ0.20mol?L-1��MgCl2��CuCl2�����Һ����μ��백ˮ��������
���㣺pH�ļ���,���ܵ���ʵ��ܽ�ƽ�⼰����ת���ı���
ר�⣺����ƽ������Һ��pHר��
��������1��25��ʱ���û����Һ��pH=7����Һ�����ԣ������ǡ���кͣ���n��OH-��=n��H+����
��2������AgCl��Һ�д����ܽ�ƽ�⣬�����Ӻ������Ӷ�����AgCl�ܽ⣬�����ӻ�������Ũ��Խ�������Ƴ̶�Խ��
��3���������ܶȻ�����С���ȳ����������ܶȻ�������Դ�С֪��Cu��OH��2�����ɳ��������ӷ���ʽΪCu2++2NH3?H2O=Cu��OH��2��+2NH4+������Һ��C��Cu2+��=10-5 mol/Lʱ����Ϊͭ������ȫ�������ٸ���������þ�ܶȻ�������pH����c��Mg2+����
��2������AgCl��Һ�д����ܽ�ƽ�⣬�����Ӻ������Ӷ�����AgCl�ܽ⣬�����ӻ�������Ũ��Խ�������Ƴ̶�Խ��
��3���������ܶȻ�����С���ȳ����������ܶȻ�������Դ�С֪��Cu��OH��2�����ɳ��������ӷ���ʽΪCu2++2NH3?H2O=Cu��OH��2��+2NH4+������Һ��C��Cu2+��=10-5 mol/Lʱ����Ϊͭ������ȫ�������ٸ���������þ�ܶȻ�������pH����c��Mg2+����
���
�⣺��1��25��ʱ���û����Һ��pH=7����Һ�����ԣ������ǡ���кͣ���n��OH-��=n��H+������amL��0.1mol/L=b mol��0.05mol/L��2����a��b=1��1���ʴ�Ϊ��1��1��
��2������AgCl��Һ�д����ܽ�ƽ�⣬�����Ӻ������Ӷ�����AgCl�ܽ⣬�����ӻ�������Ũ��Խ�������Ƴ̶�Խ��B��C��D������AgCl�ܽ⣬��B��c��Ag+�����C��������Ũ�ȴ���D������C����AgCl�ܽ�̶�������ֽ����c��Ag+����С˳����B��A��D��C������c��Ag+����С����C����ѡC��
��3���������ܶȻ�����С���ȳ����������ܶȻ�������Դ�С֪��Cu��OH��2�����ɳ��������ӷ���ʽΪCu2++2NH3?H2O=Cu��OH��2��+2NH4+����ҺpH=11������Һ��c��OH-��=0.001mol/L���ٸ����ܶȻ�������c��Mg2+��=
mol/L=1.8��10-5mol/L��c��Cu2+��=
mol/L=2.0��10-14mol/L������c��Mg2+����c��Cu2+��=1.8��10-5mol/L��2.0��10-14mol/L=9.0��108��
�ʴ�Ϊ��Cu��OH��2��Cu2++2NH3?H2O=Cu��OH��2��+2NH4+��9.0��108��
��2������AgCl��Һ�д����ܽ�ƽ�⣬�����Ӻ������Ӷ�����AgCl�ܽ⣬�����ӻ�������Ũ��Խ�������Ƴ̶�Խ��B��C��D������AgCl�ܽ⣬��B��c��Ag+�����C��������Ũ�ȴ���D������C����AgCl�ܽ�̶�������ֽ����c��Ag+����С˳����B��A��D��C������c��Ag+����С����C����ѡC��
��3���������ܶȻ�����С���ȳ����������ܶȻ�������Դ�С֪��Cu��OH��2�����ɳ��������ӷ���ʽΪCu2++2NH3?H2O=Cu��OH��2��+2NH4+����ҺpH=11������Һ��c��OH-��=0.001mol/L���ٸ����ܶȻ�������c��Mg2+��=
| 1.8��10-11 |
| (0.001)2 |
| 2.0��10-20 |
| (10-3)2 |
�ʴ�Ϊ��Cu��OH��2��Cu2++2NH3?H2O=Cu��OH��2��+2NH4+��9.0��108��
���������⿼����pH�ļ��㡢��������ܽ�ƽ���֪ʶ�㣬������������ܽ��ص㡢�ܶȻ������и���������֮��Ĺ�ϵ���㣬ע�⣨2������ȻB����AgCl�ܽ⣬���������ǿ��ܵģ�����B��������Ũ�����Ϊ�״��㣮

��ϰ��ϵ�д�
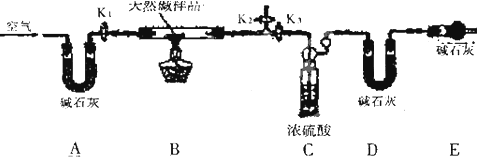
�����Ŀ
����������������ֱ�Ӽ��ȵ������ǣ�������
���Թܣ����ձ�������Ͳ����������������������ƿ��
���Թܣ����ձ�������Ͳ����������������������ƿ��
| A���٢ܢ� | B���ڢܢ� |
| C���٢ۢ� | D���٢ڢݢ� |
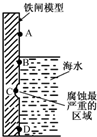
��������������ʴʱ�������ĵ缫��Ӧʽ�ǣ�������
| A��Fe-3e-=Fe3+ |
| B��O2+2H2O+4e-=4OH- |
| C��Fe-2e-=Fe2+ |
| D��O2+2H2O-4e-=4OH- |

 �����仯�����������������ϵ���У�
�����仯�����������������ϵ���У� ��һ���Ϊ10L�������У�ͨ��һ������CO��H2O����850��ʱ�������·�Ӧ��CO��g��+H2O��g��?CO2��g��+H2 ��g����H��0����K=1��
��һ���Ϊ10L�������У�ͨ��һ������CO��H2O����850��ʱ�������·�Ӧ��CO��g��+H2O��g��?CO2��g��+H2 ��g����H��0����K=1��