题目内容
(1)下列7种固态物质:P4(白磷)、NH4Cl、Ca(OH)2、NaF、CO2、金刚石,回答下列问题(填写化学式或名称)
①熔化时不需要破坏化学键的是 ,熔化时需要破坏共价键的是 ;
②晶体中既有离子键又有共价键的是 .
③P4(白磷)、SiO2、NaF、CO2四种晶体熔点由高到低的顺序为 .
(2)某元素最高正化合价为+6,其最低负价为 .某元素R与氢形成的气态氢化物的化学式为RH3,其最高价氧化物的化学式为 .
①熔化时不需要破坏化学键的是
②晶体中既有离子键又有共价键的是
③P4(白磷)、SiO2、NaF、CO2四种晶体熔点由高到低的顺序为
(2)某元素最高正化合价为+6,其最低负价为
考点:共价键的形成及共价键的主要类型,常见元素的化合价,晶体熔沸点的比较
专题:化学键与晶体结构
分析:(1)①分子晶体熔化时破坏分子间作用力;原子晶体熔化时破坏共价键;
②活泼金属与活泼非金属之间形成离子键,非金属之间形成共价键;
③熔点的一般规律:原子晶体>离子晶体>分子晶体;
(2)元素的最高正化合价与最低负化合价的绝对值之和为8;根据化合物中化合价的代数和为零分析.
②活泼金属与活泼非金属之间形成离子键,非金属之间形成共价键;
③熔点的一般规律:原子晶体>离子晶体>分子晶体;
(2)元素的最高正化合价与最低负化合价的绝对值之和为8;根据化合物中化合价的代数和为零分析.
解答:
解:(1)①P4、CO2属于分子晶体,熔化时破坏分子间作用力;金刚石属于原子晶体,熔化时破坏共价键;
故答案为:P4、CO2;金刚石;
②活泼金属与活泼非金属之间形成离子键,铵根离子与阴离子之间形成离子键,非金属之间形成共价键,则晶体中既有离子键又有共价键的是NH4Cl、Ca(OH)2;
故答案为:NH4Cl、Ca(OH)2;
③SiO2属于原子晶体,NaF属于离子晶体,白磷和二氧化碳属于分子晶体,常温下白磷为固体,CO2是气体,则熔点:SiO2>NaF>P4(白磷)>CO2;
故答案为:SiO2>NaF>P4(白磷)>CO2;
(2)已知元素最高正化合价为+6,则其负化合价为-2;某元素R与氢形成的气态氢化物的化学式为RH3,则R的负价为-3,所以最高正化合价为+5,则其最高价氧化物的化学式为R2O5,
故答案为:-2;R2O5.
故答案为:P4、CO2;金刚石;
②活泼金属与活泼非金属之间形成离子键,铵根离子与阴离子之间形成离子键,非金属之间形成共价键,则晶体中既有离子键又有共价键的是NH4Cl、Ca(OH)2;
故答案为:NH4Cl、Ca(OH)2;
③SiO2属于原子晶体,NaF属于离子晶体,白磷和二氧化碳属于分子晶体,常温下白磷为固体,CO2是气体,则熔点:SiO2>NaF>P4(白磷)>CO2;
故答案为:SiO2>NaF>P4(白磷)>CO2;
(2)已知元素最高正化合价为+6,则其负化合价为-2;某元素R与氢形成的气态氢化物的化学式为RH3,则R的负价为-3,所以最高正化合价为+5,则其最高价氧化物的化学式为R2O5,
故答案为:-2;R2O5.
点评:本题考查了离子键、共价键、物质熔沸点的比较等,明确这几个概念的内涵是解本题关键,注意这几个概念的区别,注意不能根据是否含有金属元素判断离子键,如铵盐,为易错点.

练习册系列答案
相关题目
在我国最早使用的合金是( )
| A、青铜 | B、白铜 | C、生铁 | D、石块 |

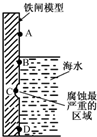 铁及其化合物与生产、生活关系密切.
铁及其化合物与生产、生活关系密切.