题目内容
6.取100mL等物质的量浓度的硝酸和硫酸混合溶液,当加入200mL 1.5mol•L-1的Ba(OH)2溶液时,溶液显中性.请计算:(1)原混合液中H+的物质的量浓度为6mol•L-1.
(2)当原混合液中加入0.5molCu,最终剩余铜的质量为17.6g.
分析 (1)混合溶液呈中性,说明酸碱恰好完全反应生成盐和水,则酸中n(H+)=n(OH-);
(2)因为两种酸的物质的量相等,则硝酸和硫酸中氢离子浓度之比为1:2,根据c(H+)确定两种酸的物质的量浓度,再根据转移电子相等计算剩余Cu的质量.
解答 解:(1)混合溶液呈中性,说明酸碱恰好完全反应生成盐和水,则酸中n(H+)=n(OH-),设原溶液中c(H+)=xmol/L,
则xmol/L×0.1L=1.5mol/L×2×0.2L,x=6,
故答案为:6;
(2)因为两种酸的物质的量相等,则硝酸和硫酸中氢离子浓度之比为1:2,c(H+)=6mol/L,则两种酸的浓度都是2mol/L,n(HNO3)=n(H2SO4)=2mol/L×0.1L=0.2mol,Cu和硝酸反应离子方程式为3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,原酸溶液中n(H+)=6mol/L×0.1L=0.6mol,根据N原子守恒得n(NO3-)=n(HNO3)=0.2mol,
根据方程式知,如果硝酸根离子完全反应,则需要n(H+)=0.8mol>0.6mol,所以氢离子不足量,以氢离子为标准进行计算,则n(Cu)=$\frac{0.6mol}{8}×3$=0.225mol,则剩余m(Cu)=(0.5-0.225)mol×64g/mol=17.6g,
故答案为:17.6.
点评 本题考查化学方程式有关计算,为高频考点,侧重考查学生分析计算能力,明确各个物理量之间的关系式是解本题关键,注意(2)要进行过量计算,否则会得出错误结论,为易错点.

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目
12.乙烯与酸性高锰酸钾反应会放出CO2,下列操作中既可以用来鉴别乙烯和乙烷,又可以用来除去乙烷中混有的少量乙烯的操作方法是( )
| A. | 混合气通过盛有水的洗气瓶 | |
| B. | 混合气与过量氢气混合 | |
| C. | 混合气通过装有酸性高锰酸钾溶液的洗气瓶 | |
| D. | 通过装有过量溴水的洗气瓶 |
14.某一有机物A可发生下列变化 已知C为羧酸,且C、E均不能发生银镜反应,则A的可能结构有( )
已知C为羧酸,且C、E均不能发生银镜反应,则A的可能结构有( )
 已知C为羧酸,且C、E均不能发生银镜反应,则A的可能结构有( )
已知C为羧酸,且C、E均不能发生银镜反应,则A的可能结构有( )| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
11.下列做法会对人体健康造成较大危害的是( )
| A. | 用小苏打(NaHCO3)发酵面粉蒸馒头 | B. | 用食醋清洗暖水瓶底的水垢(CaCO3) | ||
| C. | 用SO2漂白银耳、腐竹等食品 | D. | 自来水中通入少量Cl2进行消毒 |
18.下列有关化学用语的表述正确的是( )
| A. | 质子数为35、中子数为45的溴原子:${\;}_{45}^{80}$Br | |
| B. | 丙烷分子的球棍模型为: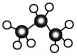 | |
| C. | 次氯酸的电子式为: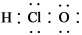 | |
| D. | -OH与OH-组成元素相同,含有的电子数也相同 |
15.已知OCN-中C显+4价,在反应OCN-+OH-+Cl2→CO2+N2+Cl-+H2O(未配平)中,如果有6mol Cl2完全反应,则被氧化的OCN-的物质的量是( )
| A. | 2 mol | B. | 3 mol | C. | 6mol | D. | 4 mol |
