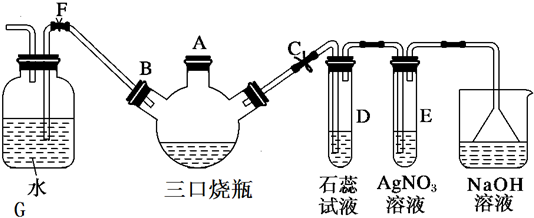
题目内容
10.设NA为阿伏加德罗常数,下列说法正确的是( )| A. | 标准状况下,5.6L CCl4含有的分子数为0.25NA | |
| B. | 标准状况下,14 g氮气含有的核外电子数为5NA | |
| C. | 标准状况下,22.4 L任意比的氢气和氯气的混气中含有分子总数均为NA | |
| D. | 在标准状况下,18gH2O所含有的电子数不是10NA |
分析 A、标况下四氯化碳为液体;
B、求出氮气的物质的量,然后根据氮气中含14个电子来分析;
C、求出混合气体的物质的量,然后根据分子个数N=nNA来计算;
D、求出水的物质的量,然后根据水中含10个电子来分析.
解答 解:A、标况下四氯化碳为液体,故不能根据气体摩尔体积来计算其物质的量,故A错误;
B、14g氮气的物质的量为0.5mol,而氮气中含14个电子,故0.5mol氮气中含7NA个电子,故B错误;
C、标况下22.4L混合气体的物质的量为1mol,而分子个数N=nNA=NA个,故C正确;
D、18g水的物质的量为1mol,而水中含10个电子,故1mol水中含10NA个电子,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.

练习册系列答案
 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案
相关题目
15.FeCO3与砂糖混用可以作补血剂,实验室里制备FeCO3的流程如图所示.下列说法错误的是( )
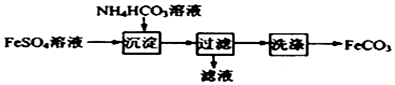

| A. | 产品FeCO3在空气中高温分解可得到纯净的FeO | |
| B. | 可利用KSCN溶液检验FeSO4溶液是否变质 | |
| C. | 沉淀过程中有CO2气体放出 | |
| D. | 检验沉淀是否洗涤干净可用盐酸酸化的BaCl2溶液 |
2.可证明次氯酸是弱酸的事实是( )
| A. | 次氯酸可与碱反应 | B. | 次氯酸有漂白性 | ||
| C. | 次氯酸钙可与碳酸反应生成次氯酸 | D. | 次氯酸见光分解 |
19.已知:
CH3CH2CH2CH3(g)+$\frac{13}{2}$O2(g)═4CO2(g)+5H2O(l)△H=-2 878kJ/mol
(CH3)2CHCH3(g)+$\frac{13}{2}$O2(g)═4CO2(g)+5H2O(l)△H=-2 869kJ/mol
下列说法正确的是( )
CH3CH2CH2CH3(g)+$\frac{13}{2}$O2(g)═4CO2(g)+5H2O(l)△H=-2 878kJ/mol
(CH3)2CHCH3(g)+$\frac{13}{2}$O2(g)═4CO2(g)+5H2O(l)△H=-2 869kJ/mol
下列说法正确的是( )
| A. | 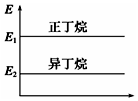 正丁烷与异丁烷的能量大小关系如图 | |
| B. | 正丁烷的稳定性大于异丁烷 | |
| C. | 异丁烷转化为正丁烷的过程是一个放热过程 | |
| D. | 异丁烷分子中的碳氢键比正丁烷的多 |
 有可逆反应:Fe(s)+CO2(g)?FeO(s)+CO(g).已知938K时平衡常数K=1.47,1173K时平衡常数K=2.15.
有可逆反应:Fe(s)+CO2(g)?FeO(s)+CO(g).已知938K时平衡常数K=1.47,1173K时平衡常数K=2.15. 已知KMnO4、MnO2在酸性条件下均能将草酸 (H2C2O4)氧化:
已知KMnO4、MnO2在酸性条件下均能将草酸 (H2C2O4)氧化: