题目内容
1.下列有关仪器的性能或者使用方法的说明中正确的是( )| A. | 试管、蒸发皿既能用于给固体加热也能用于给溶液加热 | |
| B. | 分液漏斗既能用于某些混合物的分离也能用于组装气体发生装置 | |
| C. | 碱式滴定管既可用于中和滴定,也可用于量取一定量的NaCl或AlCl3溶液 | |
| D. | 测量酒精沸点的实验中,应使温度计水银球位于被加热的酒精中 |
分析 A.蒸发皿不能用来加热固体;
B.分液漏斗可用于分液以及气体的制备;
C.碱式滴定管只能量取中性或者碱性液体;
D.测量酒精沸点实际测量的是蒸汽的温度.
解答 解:A.试管既能用于给固体加热也能用于给溶液加热,蒸发皿不能用来给固体加热,故A错误;
B.分液漏斗可用于分液以及气体的制备,如实验室制备氯气,可用分液漏斗加入浓盐酸,故B正确;
C.氯化铝为强酸弱碱盐,水解显酸性,不能用碱式滴定管量取,故C错误;
D.测量酒精沸点实际测量的是蒸汽的温度,温度计应放在蒸馏烧瓶的支管口处,故D错误;
故选:B.
点评 本题考查了实验室常用仪器的使用方法和注意事项,明确各仪器的构造及用途是解题关键,题目难度不大.

练习册系列答案
 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案
相关题目
11.在实验室中配制一定物质的量浓度溶液的有关操作中,正确的是( )
| A. | 配制0.1mol•L-1NaOH溶液过程中,将NaOH固体放在滤纸上称量 | |
| B. | 配制0.1mol•L-1的H2SO4溶液时,将量取的浓H2SO4放入容量瓶中加水稀释 | |
| C. | 配制0.1mol•L-1的NaCl溶液时,最后用胶头滴管加水至刻度线 | |
| D. | 配制0.1mol•L-1的HCl溶液时,要将量取浓盐酸的量筒和溶解用的烧杯洗涤2~3次,并将洗涤液转入容量瓶中 |
12.短周期元素X、Y、Z在周期表中的位置关系如图所示,下列有关叙述正确的是( )
| X | ||
| Y | ||
| Z |
| A. | Z与铁反应生成的化合物中铁元素显正三价 | |
| B. | X的最高价氧化物的水化物是一种强酸 | |
| C. | 1 mol单质Y跟足量水反应时,转移1 mol电子 | |
| D. | Z有ZO2、ZO3两种氧化物 |
9.设NA为阿伏伽德罗常数的值( )
| A. | ag某气体的分子数为b,则cg该气体在标况下的体积为$\frac{22.4bc}{a{N}_{A}}$L | |
| B. | 2L0.5mol.L-1磷酸溶液中含有H+的数目为3NA | |
| C. | 25℃,PH=13的Ba(OH)2溶液中含有OH-为0.1NA | |
| D. | 标准状况下,28g乙烯和丙烯的混合气体中,含有碳碳双键的数目为NA |
16.下列实验能够成功的是( )
| A. | 通过溴水除去甲烷中的乙炔 | |
| B. | 将乙醇加热到170℃制备乙烯 | |
| C. | 加入浓溴水后过滤除去苯中的苯酚 | |
| D. | 加入氢氧化钠后蒸馏除去乙酸乙酯中的乙酸 |
13.X、Y、Z、W、M是短周期5种主族元素,X-与氦原子电子层结构相同,Y原子的电子总数等于其电子层数的3倍,Z的最高化合价为最低化合价绝对值的3倍,W的单质可与钠反应生成阴阳离子个数比为1:2的淡黄色固体化合物,M的氢化物与其最高价氧化物的水化物可发生化合反应生成盐,下列叙述正确的是( )
| A. | 五种元素的原子半径从大到小的顺序是:Z>W>M>Y>X | |
| B. | 氢化物的还原性:Y>M>W | |
| C. | Y和M的氧化物都是酸性氧化物 | |
| D. | X2Z的电子式为: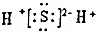 |
14.要除去FeCl2溶液中少量的FeCl3杂质,应选用下列试剂中的( )
| A. | Fe | B. | Cu | C. | 氯水 | D. | KSCN溶液 |
15.K、Ka、KW分别表示化学平衡常数、电离平衡常数和水的离子积,下列判断正确的是( )
| A. | 温度升高,三者都增大 | |
| B. | 室温下Ka(HCN)<Ka(CH3COOH),说明CH3COOH的电离度一定比HCN大 | |
| C. | 2SO2(g)+O2(g)?2SO3(g)平衡后,仅增大压强,平衡向右移动,但K值不变 | |
| D. | 化学平衡常数的大小与温度、浓度、催化剂等有关 |