题目内容
12.短周期元素X、Y、Z在周期表中的位置关系如图所示,下列有关叙述正确的是( )| X | ||
| Y | ||
| Z |
| A. | Z与铁反应生成的化合物中铁元素显正三价 | |
| B. | X的最高价氧化物的水化物是一种强酸 | |
| C. | 1 mol单质Y跟足量水反应时,转移1 mol电子 | |
| D. | Z有ZO2、ZO3两种氧化物 |
分析 这几种元素都是短周期元素,由X、Y、Z在周期表中的位置可知X为He、Y为F、Z为S元素,
A.S单质具有弱氧化性,能将变价金属氧化为较低价态;
B.X是稀有气体,没有氧化物;
C.氟气和水反应方程式为2F2+2H2O=4HF+O2,根据氟气和转移电子之间的关系式计算;
D.Z是S元素,S元素的氧化物有两种.
解答 解:这几种元素都是短周期元素,由X、Y、Z在周期表中的位置可知X为He、Y为F、Z为S元素,
A.S单质具有弱氧化性,能将变价金属氧化为较低价态,S和Fe发生化合反应生成FeS,FeS中Fe元素化合价为+2价,故A错误;
B.X是稀有气体,没有氧化物,所以He没有最高价氧化物的水化物,故B错误;
C.氟气和水反应方程式为2F2+2H2O=4HF+O2,根据氟气和转移电子之间的关系式得1 mol单质Y跟足量水反应时,转移电子物质的量=1 mol×2×[0-(-1)]=2mol,故C错误;
D.Z是S元素,S元素有SO2、SO3两种氧化物,故D正确;
故选D.
点评 本题考查元素周期表和元素周期律的综合应用,为高频考点,明确元素周期表结构、元素化合物性质及元素周期律是解本题关键,注意:氟气和水反应与其它卤族元素单质与水反应区别,为易错点.

练习册系列答案
 智能训练练测考系列答案
智能训练练测考系列答案
相关题目
2.在一定温度下的定容密闭容器中,发生反应:2NO2(g)?N2O4(g).当下列所给有关量不再变化时,不能表明该反应已达平衡状态的是( )
| A. | 混合气体的压强 | B. | 混合气体的密度 | ||
| C. | 混合气体的平均相对分子质量 | D. | $\frac{c({N}_{2}{O}_{4})}{{c}^{2}(N{O}_{2})}$ |
3. 已知:反应I:4NH3(g)+6NO(g)?5N2(g)+6H2O(l)△H1
已知:反应I:4NH3(g)+6NO(g)?5N2(g)+6H2O(l)△H1
反应Ⅱ:2NO(g)+O2(g)?2NO2(g)△H2(且|△H1|=2|△H2|)
反应Ⅲ:4NH3(g)+6NO2(g)?5N2(g)+3O2(g)+6H2O(l)△H 3
反应I和反应Ⅱ在不同温度时的平衡常数及其大小关系如下表
(1)△H3=△H1-3△H2(用△H1、△H2的代数式表示);推测反应Ⅲ是吸热反应(填“吸热”或“放热”)
(2)相同条件下,反应I:4NH3(g)+6NO(g)?5N2(g)+6H2O(l)在2L密闭容器内,选用不同的催化剂,反应产生N2的量随时间变化如图所示.
①计算0~4分钟在A催化剂作用下,反应速率V(NO)=0.375mol•L-1•min-1.
②下列说法不正确的是CD.
A.单位时间内H-O键与N-H键断裂的数目相等时,说明反应已经达到平衡
B.若在恒容绝热的密闭容器中发生反应,当K值不变时,说明反应已经达到平衡
C.该反应的活化能大小顺序是:Ea(A)>Ea(B)>Ea(C)
D.增大压强能使反应速率加快,是因为增加了活化分子百分数
(3)一定条件下,反应II达到平衡时体系中n(NO):n(O2):n(NO2)=2:1:2.
①保持恒温恒容,再充入NO2气体,NO2体积分数变大(填“变大”、“变小”或“不变”)
②关于平衡体系反应Ⅱ:2NO(g)+O2(g)?2NO2(g);△H2说法正确的是AC.
A、该反应焓变为负值
B、升高温度,逆反应速率增大,正反应速率减小,反应逆向移动
C、不论增大压强还是减小压强,正方向速率改变的程度更大
D、平衡正向移动,NO的转化率一定增大
E、平衡体系中加入NO2,平衡逆向移动,△H2减小
F、混合气体颜色加深说明平衡向右移动,颜色变浅则向左移动.
 已知:反应I:4NH3(g)+6NO(g)?5N2(g)+6H2O(l)△H1
已知:反应I:4NH3(g)+6NO(g)?5N2(g)+6H2O(l)△H1反应Ⅱ:2NO(g)+O2(g)?2NO2(g)△H2(且|△H1|=2|△H2|)
反应Ⅲ:4NH3(g)+6NO2(g)?5N2(g)+3O2(g)+6H2O(l)△H 3
反应I和反应Ⅱ在不同温度时的平衡常数及其大小关系如下表
| 温度/K | 反应I | 反应II | 已知: K2>K1 >K2′>K1′ |
| 298 | K1 | K2 | |
| 398 | K1′ | K2′ |
(2)相同条件下,反应I:4NH3(g)+6NO(g)?5N2(g)+6H2O(l)在2L密闭容器内,选用不同的催化剂,反应产生N2的量随时间变化如图所示.
①计算0~4分钟在A催化剂作用下,反应速率V(NO)=0.375mol•L-1•min-1.
②下列说法不正确的是CD.
A.单位时间内H-O键与N-H键断裂的数目相等时,说明反应已经达到平衡
B.若在恒容绝热的密闭容器中发生反应,当K值不变时,说明反应已经达到平衡
C.该反应的活化能大小顺序是:Ea(A)>Ea(B)>Ea(C)
D.增大压强能使反应速率加快,是因为增加了活化分子百分数
(3)一定条件下,反应II达到平衡时体系中n(NO):n(O2):n(NO2)=2:1:2.
①保持恒温恒容,再充入NO2气体,NO2体积分数变大(填“变大”、“变小”或“不变”)
②关于平衡体系反应Ⅱ:2NO(g)+O2(g)?2NO2(g);△H2说法正确的是AC.
A、该反应焓变为负值
B、升高温度,逆反应速率增大,正反应速率减小,反应逆向移动
C、不论增大压强还是减小压强,正方向速率改变的程度更大
D、平衡正向移动,NO的转化率一定增大
E、平衡体系中加入NO2,平衡逆向移动,△H2减小
F、混合气体颜色加深说明平衡向右移动,颜色变浅则向左移动.
20.下列说法中正确的是( )
| A. | 按系统命名法,化合物 (键线式结构)的名称是2,3,5,5-四甲基-4,4-二乙基己烷 (键线式结构)的名称是2,3,5,5-四甲基-4,4-二乙基己烷 | |
| B. | 环己烯与化合物 (键线式结构)互为同系物 (键线式结构)互为同系物 | |
| C. | 分子式为C4H8O2的有机物在酸性条件下可水解为酸和醇,若将所有可能得到的醇和酸重新酯化,可形成的酯共有16种 | |
| D. | 等物质的量的苯和苯甲酸完全燃烧消耗氧气的量相等 |
17.在Na+浓度为0.5 mol•l-1的某澄清溶液中,还可能含有表中的若干种离子.
现取该溶液100mL进行如下实验(气体体积均在标准状况下测定).
请回答下列问题.
(1)实验Ⅰ能确定一定不存在的离子是Ag+、Mg2+、Ba2+.
(2)实验Ⅰ中生成沉淀的离子方程式为SiO32-+2H+=H2SiO3↓.
(3)通过实验Ⅰ、Ⅱ、Ⅲ和必要计算,填写下表中阴离子的浓度(能计算出的,填写计算结果,一定不存在的离子填“0”,不能确定是否存在的离子填“?”).
| 阳离子 | K+ Ag+ Mg2+ Ba2+ |
| 阴离子 | NO3- CO32- SiO32- SO42- |
| 序号 | 实验内容 | 实验结果 |
| Ⅰ | 向该溶液中加入足量稀盐酸 | 产生白色沉淀并放出标准状况下0.56L气体 |
| Ⅱ | 将Ⅰ的反应混合液过滤,对沉淀洗涤、灼烧至恒重,称量所得固体质量 | 固体质量为2.4g |
| Ⅲ | 向Ⅱ的滤液中滴加BaCl2溶液 | 无明显现象 |
(1)实验Ⅰ能确定一定不存在的离子是Ag+、Mg2+、Ba2+.
(2)实验Ⅰ中生成沉淀的离子方程式为SiO32-+2H+=H2SiO3↓.
(3)通过实验Ⅰ、Ⅱ、Ⅲ和必要计算,填写下表中阴离子的浓度(能计算出的,填写计算结果,一定不存在的离子填“0”,不能确定是否存在的离子填“?”).
| 阴离子 | NO3- | CO32- | SiO32- | SO42- |
| c(mol•h-1) |
4.实验室配制250mL 0.5mo1•L-1NaCl溶液,不需要用到的仪器是( )
| A. |  玻璃棒 | B. |  酒精灯 | C. | 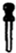 胶头滴管 | D. |  容量瓶 |
1.下列有关仪器的性能或者使用方法的说明中正确的是( )
| A. | 试管、蒸发皿既能用于给固体加热也能用于给溶液加热 | |
| B. | 分液漏斗既能用于某些混合物的分离也能用于组装气体发生装置 | |
| C. | 碱式滴定管既可用于中和滴定,也可用于量取一定量的NaCl或AlCl3溶液 | |
| D. | 测量酒精沸点的实验中,应使温度计水银球位于被加热的酒精中 |
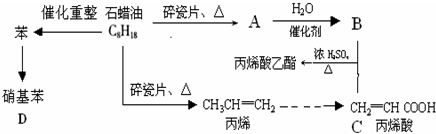
 A→B的反应类型:加成反应
A→B的反应类型:加成反应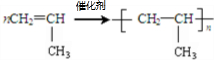 ;
;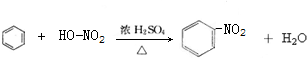 ,
,