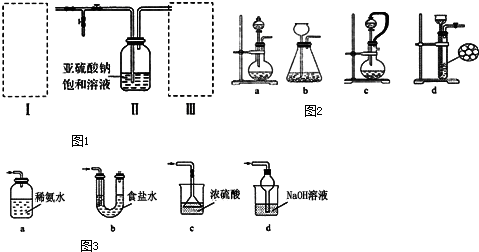
题目内容
16.下列实验能够成功的是( )| A. | 通过溴水除去甲烷中的乙炔 | |
| B. | 将乙醇加热到170℃制备乙烯 | |
| C. | 加入浓溴水后过滤除去苯中的苯酚 | |
| D. | 加入氢氧化钠后蒸馏除去乙酸乙酯中的乙酸 |
分析 A.乙炔能和溴发生加成反应,甲烷和溴不反应;
B.乙醇发生消去反应生成乙烯需要浓硫酸作催化剂;
C.溴和苯酚生成的三溴苯酚能溶于苯;
D.NaOH能和乙酸、乙酸乙酯反应.
解答 解:A.乙炔能和溴发生加成反应,甲烷和溴不反应,所以可以用溴水除去甲烷中的乙炔,采用洗气方法分离提纯,故A正确;
B.乙醇发生消去反应生成乙烯需要浓硫酸作催化剂,该实验没有浓硫酸,实验不成功,故B错误;
C.溴和苯酚生成的三溴苯酚能溶于苯,苯酚和NaOH反应生成可溶性的苯酚钠,苯和NaOH不反应,应该用NaOH除去苯中的苯酚,故C错误;
D.NaOH能和乙酸、乙酸乙酯反应,饱和碳酸钠能和乙酸反应生成乙酸钠,乙醇能溶于饱和碳酸钠,饱和碳酸钠能抑制乙酸乙酯溶解,所以用饱和碳酸钠溶液除去乙酸乙酯中的乙酸,故D错误;
故选A.
点评 本题考查化学实验方案评价,为高频考点,明确实验原理及物质性质差异性是解本题关键,根据物质性质差异性选取合适的分离提纯方法,注意除杂时不能引进新的杂质且操作简单,题目难度不大.

练习册系列答案
相关题目
4.实验室配制250mL 0.5mo1•L-1NaCl溶液,不需要用到的仪器是( )
| A. |  玻璃棒 | B. |  酒精灯 | C. |  胶头滴管 | D. |  容量瓶 |
11.化学是一门实用性强的自然科学,在社会、生产、生活中起着重要的作用,下列说法不正确的是( )
| A. | 油条的制作口诀是“一碱、二矾、三钱盐”,其中的“碱”是烧碱 | |
| B. | 黑火药的最优化配方是“一硫二硝三木炭”,其中的“硝”是硝酸钾 | |
| C. | 过滤操作要领是“一贴二低三靠”,其中“贴”是指滤纸紧贴漏斗的内壁 | |
| D. | “固体需匙或纸槽,一送二竖三弹弹;块固还是镊子好,一横二放三慢竖“.前一个固体一般指粉末状固体 |
1.下列有关仪器的性能或者使用方法的说明中正确的是( )
| A. | 试管、蒸发皿既能用于给固体加热也能用于给溶液加热 | |
| B. | 分液漏斗既能用于某些混合物的分离也能用于组装气体发生装置 | |
| C. | 碱式滴定管既可用于中和滴定,也可用于量取一定量的NaCl或AlCl3溶液 | |
| D. | 测量酒精沸点的实验中,应使温度计水银球位于被加热的酒精中 |
8.据报道,美国夏威夷联合中心的科学家发现了新型的氢粒子,这种新粒子由3个氢原子核(只有质子)和2个电子构成.关于这种粒子下说法正确的是( )
| A. | 这种粒子中含有3个质子 | B. | 它的组成可用H3表示 | ||
| C. | 这种粒子中含有3个中子 | D. | 是氢的一种新的同位素 |
10.下列各项中的两个量,其比值一定为2:1的是( )
| A. | 在相同温度下,等浓度的H2SO4和CH3COOH溶液中的c(H+) | |
| B. | 相同温度下,等浓度的Ba(OH)2和NaOH溶液,前者与后者的c(OH-) | |
| C. | 相同温度下,0.2 mol•L-1醋酸溶液和0.1 mol•L-1醋酸溶液中的c(H+) | |
| D. | 液面在“0”刻度时,50 mL碱式滴定管和25 mL碱式滴定管所盛液体的体积 |