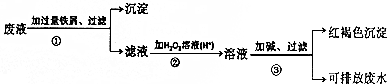
题目内容
14.下列有关电池的说法不正确的是( )| A. | 太阳能电池的主要材料是高纯度的二氧化硅 | |
| B. | 铜锌原电池工作时,电子沿外电路从锌电极流向铜电极 | |
| C. | 氮氧燃料电池工作时,氮气在负极被氧化 | |
| D. | 原电池中一定发生了氧化还原反应 |
分析 A.太阳能电池的主要材料是硅;
B.铜锌原电池放电时,电子从负极沿导线流向正极;
C.燃料电池中燃料在负极上被氧化;
D.原电池反应的实质是自发的氧化还原反应.
解答 解:A.太阳能电池的主要材料是半导体硅,光导纤维的主要材料是二氧化硅,故A错误;
B.铜锌原电池中锌易失电子作负极,铜作正极,放电时,电子从负极锌沿导线流向正极铜,故B正确;
C.燃料电池中,燃料易失电子而发生氧化反应,所以氮气在负极上被氧化,故C正确;
D.原电池反应的实质是自发的氧化还原反应,所以原电池中一定发生了氧化还原反应,故D正确;
故选A.
点评 本题考查了原电池原理,明确正负极上反应类型、电子流向即可解答,难度不大,侧重于学生的分析能力的考查.

练习册系列答案
相关题目
4.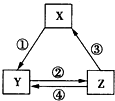 下表中各组物质之间通过一步反应不可能实现如图所示转化关系的是( )
下表中各组物质之间通过一步反应不可能实现如图所示转化关系的是( )
 下表中各组物质之间通过一步反应不可能实现如图所示转化关系的是( )
下表中各组物质之间通过一步反应不可能实现如图所示转化关系的是( )| 选项 | X | Y | Z |
| A | Mg | MgO | MgCl2 |
| B | Fe | FeCl3 | FeCl2 |
| C | Na2CO3 | NaOH | NaHCO3 |
| D | Cl2 | Ca(ClO)2 | HClO |
| A. | A | B. | B | C. | C | D. | D |
5.用放射性同位素${\;}_{16}^{35}$S对杀虫剂进行标记,可跟踪杀虫剂的污染途径.该原子的中子数是( )
| A. | 16 | B. | 35 | C. | 19 | D. | 51 |
2.下列离子方程式的书写正确的是( )
| A. | 大理石与盐酸反应:CO32-+2H+═CO2↑+H2O | |
| B. | 铜和硝酸银溶液反应:Cu+Ag+═Cu2++Ag | |
| C. | 氯气溶于水:Cl2+H2O═2H++Cl-+ClO- | |
| D. | 硫酸与氢氧化钡溶液反应:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O |
19.在一定温度时,N2与H2反应过程中能量变化的曲线如图,下列叙述正确的是( )

| A. | 该反应的热化学方程式为:N2+3H2?2NH3△H=-92KJ/mol | |
| B. | a曲线是加人催化剂时的能量变化曲线 | |
| C. | 加人催化剂,该化学反应的放热减少 | |
| D. | 反应物的总能量高于生成物的总能量 |
6.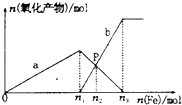 向含有1mol HNO3和1mol H2SO4的混合溶液中逐渐加人铁粉至过量溶液中金属阳离子a、b与所加铁粉的物质的量的关系如图所示(已知稀硝酸的还原产物只有NO).下列有关判断不正确的是( )
向含有1mol HNO3和1mol H2SO4的混合溶液中逐渐加人铁粉至过量溶液中金属阳离子a、b与所加铁粉的物质的量的关系如图所示(已知稀硝酸的还原产物只有NO).下列有关判断不正确的是( )
 向含有1mol HNO3和1mol H2SO4的混合溶液中逐渐加人铁粉至过量溶液中金属阳离子a、b与所加铁粉的物质的量的关系如图所示(已知稀硝酸的还原产物只有NO).下列有关判断不正确的是( )
向含有1mol HNO3和1mol H2SO4的混合溶液中逐渐加人铁粉至过量溶液中金属阳离子a、b与所加铁粉的物质的量的关系如图所示(已知稀硝酸的还原产物只有NO).下列有关判断不正确的是( )| A. | a表示Fe3+的关系曲线,b表示Fe3+的关系曲线 | |
| B. | P点时,n(Fe3+)=0.50 mol | |
| C. | n1=0.75 | |
| D. | n1:n3=2:3 |
3.1.5g 火箭燃料二甲基肼(CH3-NH-NH-CH3)完全燃烧放出50kJ热量,则二甲基肼的燃烧热为( )
| A. | 2000kJ | B. | △H=-2000kJ/mol | C. | △H=-1500kJ/mol | D. | -2000kJ/mol |
4.下列离子方程式正确的是( )
| A. | 氯化铝溶液中加入过量氨水:Al3++4NH3•H2O═AlO2-+2H2O+4NH4+ | |
| B. | 过量铁粉溶于稀硝酸:Fe+NO3-+4H+═Fe3++2H2O+NO↑ | |
| C. | 氯气与水的反应:H2O+Cl2═2H++Cl-+ClO- | |
| D. | 向明矾溶液中滴加Ba(OH)2溶液,使沉淀物质的量最大:2Al3++3 Ba2++3SO42-+6OH-═2Al(OH)3↓+3BaSO4↓ |