题目内容
3.下列关于环境污染的原因叙述不正确的是( )| A. | 重金属、农药等会造成水体污染 | |
| B. | 装饰材料中的甲醛、苯等会造成居室污染 | |
| C. | CO会导致酸雨的形成 | |
| D. | CO2的大量排放会加剧温室效应 |
分析 A.水体污染主要来自三个方面:①工业生产中废物的任意排放②农业上大量不合理地使用化肥和农药③生活污水的任意排放;
B.居室污染来源于装饰材料中的甲醛、芳香烃及氡等会造成居室污染;
C.根据酸雨的形成原因分析;
D.温室效应的罪魁祸首为二氧化碳气体.
解答 解:A.重金属、农药和难分解有机物等会造成水体污染,故A正确;
B.居室污染来源于装饰材料中的甲醛、芳香烃及氡等会造成居室污染,影响人体健康,故B正确;
C.酸雨的形成是由于SO2、NO2而引起的,CO的排放不会形成酸雨,故C错误;
D.二氧化碳气体的大量排放会加剧温室效应,故D正确;
故选C.
点评 本题考查常见的环境污染问题,题目难度不大,把握常见的有毒物质及环境污染现象为解答的关键,注意酸雨与二氧化硫、氮的氧化物有关,试题有利于提高学生的环境保护意识.

练习册系列答案
相关题目
13.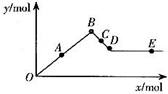 已知Ba(AlO2)2可溶于水.如图表示的是向Al2(SO4)3溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加入Ba(OH)2的物质的量x的关系.下列有关叙述正确的是( )
已知Ba(AlO2)2可溶于水.如图表示的是向Al2(SO4)3溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加入Ba(OH)2的物质的量x的关系.下列有关叙述正确的是( )
 已知Ba(AlO2)2可溶于水.如图表示的是向Al2(SO4)3溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加入Ba(OH)2的物质的量x的关系.下列有关叙述正确的是( )
已知Ba(AlO2)2可溶于水.如图表示的是向Al2(SO4)3溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加入Ba(OH)2的物质的量x的关系.下列有关叙述正确的是( )| A. | A~D时沉淀的物质的量:Al(OH)3比BaSO4多 | |
| B. | C~D时溶液中离子的物质的量:AlO2-比Ba2+多 | |
| C. | A~D时沉淀的物质的量:BaSO4可能小于Al(OH)3 | |
| D. | D~E时溶液中离子的物质的量:Ba2+可能等于OH- |
18.甲烷自热重整是先进的制氢方法,包含甲烷氧化和蒸汽重整.向反应系统同时通入甲烷、氧气和水蒸气,发生的主要化学反应有:
回答下列问题:
(1)反应CO(g)+H2O(g)=CO2(g)+H2(g)的△H=-41.2kJ/mol.
(2)在初始阶段,甲烷蒸汽重整的反应速率小于甲烷氧化的反应速率(填大于、小于或等于).
(3)对于气相反应,用某组分(B)的平衡压强(PB)代替物质的量浓度(cB)也可表示平衡常数(记作KP),则反应CH4(g)+H2O(g)?CO(g)+3H2(g)KP的表达式为$\frac{{p}^{3}({H}_{2})p(CO)}{p(C{H}_{4})p({H}_{2}O)}$;随着温度的升高,该平衡常数增大(填“增大”、“减小”或“不变”).
(4)从能量角度分析,甲烷自热重整方法的先进之处在于系统内强放热的甲烷氧化反应为强吸热的蒸汽重整反应提供了所需的能量.
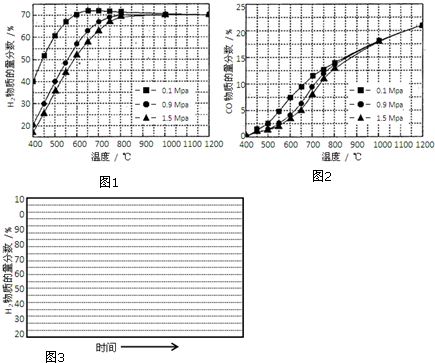
(5)在某一给定进料比的情况下,温度、压强对H2和CO物质的量分数的影响如图1、2:
①若要达到H2物质的量分数>65%、CO的物质的量分数<10%,以下条件中最合适的是B.
A.600℃,0.9Mpa B.700℃,0.9MPa C.800℃,1.5MpaD.1000℃,1.5MPa
②画出600℃,0.1Mpa条件下,系统中H2物质的量分数随反应时间(从常温进料开始计时)的变化趋势示意图3:
(6)如果进料中氧气量过大,最终导致H2物质的量分数降低,原因是甲烷氧化程度过高,导致生成的氢气和氧气反应.
| 反应 过程 | 化学方程式 | 焓变△H (kJ/mol) | 正反应活化能Ea (kJ/mol) |
| 甲烷 氧化 | CH4(g)+2O2(g)=CO2(g)+2H2O(g) | -802.6 | 125.6 |
| CH4(g)+O2(g)=CO2(g)+2H2(g) | -322.0 | 172.5 | |
| 蒸汽 重整 | CH4(g)+H2O(g)=CO(g)+3H2(g) | 206.2 | 240.1 |
| CH4(g)+2H2O(g)=CO2(g)+4H2(g) | 165.0 | 243.9 |
(1)反应CO(g)+H2O(g)=CO2(g)+H2(g)的△H=-41.2kJ/mol.
(2)在初始阶段,甲烷蒸汽重整的反应速率小于甲烷氧化的反应速率(填大于、小于或等于).
(3)对于气相反应,用某组分(B)的平衡压强(PB)代替物质的量浓度(cB)也可表示平衡常数(记作KP),则反应CH4(g)+H2O(g)?CO(g)+3H2(g)KP的表达式为$\frac{{p}^{3}({H}_{2})p(CO)}{p(C{H}_{4})p({H}_{2}O)}$;随着温度的升高,该平衡常数增大(填“增大”、“减小”或“不变”).
(4)从能量角度分析,甲烷自热重整方法的先进之处在于系统内强放热的甲烷氧化反应为强吸热的蒸汽重整反应提供了所需的能量.
(5)在某一给定进料比的情况下,温度、压强对H2和CO物质的量分数的影响如图1、2:
①若要达到H2物质的量分数>65%、CO的物质的量分数<10%,以下条件中最合适的是B.
A.600℃,0.9Mpa B.700℃,0.9MPa C.800℃,1.5MpaD.1000℃,1.5MPa
②画出600℃,0.1Mpa条件下,系统中H2物质的量分数随反应时间(从常温进料开始计时)的变化趋势示意图3:
(6)如果进料中氧气量过大,最终导致H2物质的量分数降低,原因是甲烷氧化程度过高,导致生成的氢气和氧气反应.

8.用压强传感器探究生铁在pH=2和pH=4醋酸溶液中发生腐蚀的装置及得到的图象如下:分析图象,以下结论正确的是( )


| A. | 溶液pH≤2时,生铁发生吸氧腐蚀 | |
| B. | 在酸性溶液中生铁只能发生析氢腐蚀 | |
| C. | 析氢腐蚀和吸氧腐蚀的速率一样快 | |
| D. | 两溶液中负极反应均为Fe-2e-=Fe2+ |
1.下列事实能说明乙酸(CH3COOH) 属于弱酸的是( )
①1mol/L CH3COOH的 pH=2
②乙酸能与水以任意比互溶
③20mL 1mol/L CH3COOH 与20mL 1mol/LNaOH恰好中和
④CH3COONa溶液的pH>7.
①1mol/L CH3COOH的 pH=2
②乙酸能与水以任意比互溶
③20mL 1mol/L CH3COOH 与20mL 1mol/LNaOH恰好中和
④CH3COONa溶液的pH>7.
| A. | ①② | B. | ②③ | C. | ③④ | D. | ①④ |
18.分子式为C9H10O2的芳香族化合物并且能与饱和NaHCO3溶液反应放出气体的有机物有(不含立体异构)( )
| A. | 6种 | B. | 8种 | C. | 12种 | D. | 14种 |
19.用NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 0.2 mol H2O2完全分解转移的电子数为0.4 NA | |
| B. | 1L密度为1.84g•cm-3质量分数为98%的硫酸溶液中,所含氢原子数为36.8NA | |
| C. | 在常温常压下,2.24 L SO2与O2混合气体中所含氧原子数为0.2 NA | |
| D. | 在标准状况下,2.8 g N2和2.8 g CO所含电子数均为1.4 NA |