题目内容
20.下列有关说法正确的是( )| A. | 一定条件下,使用催化剂能加快反应速率和提高反应物转化率 | |
| B. | 常温下,向水中滴加少量酸形成稀溶液,溶液中c(OH-)和水的离子积常数Kw均不变 | |
| C. | 在锌与足量稀硫酸反应溶液中加入少量铜粉溶液,可以加快反应速率但不影响产生氢气的量 | |
| D. | 在密闭绝热的容器中发生2SO2+O2?2SO3反应,当反应容器温度恒定时,反应达到平衡 |
分析 A、催化剂可以同等程度的改变正逆反应速率;
B、常温下,向水中滴加少量酸形成稀溶液,水的电受到抑制,根据Kw只受温度的影响来回答;
C、锌与足量稀硫酸反应溶液中加入少量铜粉溶液,会和金属锌反应生成金属铜,金属锌被消耗,形成了原电池;
D、化学反应容器中的温度恒定时,说明正逆反应速率相等,达到了平衡.
解答 解:A、催化剂可以同等程度的改变正逆反应速率,不能提高反应物转化率,故A错误;
B、常温下,向水中滴加少量酸形成稀溶液,水的电受到抑制,溶液中c(OH-)减硝,Kw只受温度的影响,Kw不变,故B错误;
C、锌与足量稀硫酸反应溶液中加入少量铜粉溶液,硫酸铜会和金属锌反应生成金属铜,金属锌被消耗,产生氢气的量减少,形成了原电池,可以加快反应速率,故C错误;
D、化学反应一定伴随吸放热,化学反应容器中的温度恒定时,说明正逆反应速率相等,达到了平衡状态,故D正确.
故选D.
点评 本题考查学生化学反应速率的影响因素以及化学平衡的影响因素知识,注意知识的迁移应用是关键,难度中等.

练习册系列答案
相关题目
11.控制变量法是化学实验的一种常用方法.下表是某学习小组研究等物质的量浓度的稀硫酸和锌反应的实验数据,分析以下数据,回答下列问题:
(1)化学反应速率本质上是由反应物本身的性质决定的,但外界条件也会影响反应速率的大小.本实验中实验2和实验3表明温度对反应速率有影响.
(2)我们最好选取实验1、2和4(填3个实验序号)研究锌的形状对反应速率的影响.我们发现在其它条件相同时,反应物间的接触面积越大反应速率越快.
(3)若采用与实验1完全相同的条件,但向反应容器中滴加少量硫酸铜溶液,发现反应速率明显加快.原因是锌会置换出少量的金属铜,在该条件下构成了原电池,加快了反应速率.
(4)利用表中数据,可以求得:硫酸的物质的量浓度是2mol/L.
| 序号 | 硫酸的体积/mL | 锌的质量/g | 锌的性状 | 温度/ | 完全溶于酸的时间/s | 生成硫酸锌的质量/g |
| 1 | 50.0 | 2.0 | 薄片 | 25 | 100 | m1 |
| 2 | 50.0 | 2.0 | 颗粒 | 25 | 70 | m2 |
| 3 | 50.0 | 2.0 | 颗粒 | 35 | 35 | m3 |
| 4 | 50.0 | 2.0 | 粉末 | 25 | 45 | 5.0 |
| 5 | 50.0 | 6.0 | 粉末 | 35 | 30 | m4 |
| 6 | 50.0 | 8.0 | 粉末 | 25 | t6 | 16.1 |
| 7 | 50.0 | 10.0 | 粉末 | 25 | t7 | 16.1 |
(2)我们最好选取实验1、2和4(填3个实验序号)研究锌的形状对反应速率的影响.我们发现在其它条件相同时,反应物间的接触面积越大反应速率越快.
(3)若采用与实验1完全相同的条件,但向反应容器中滴加少量硫酸铜溶液,发现反应速率明显加快.原因是锌会置换出少量的金属铜,在该条件下构成了原电池,加快了反应速率.
(4)利用表中数据,可以求得:硫酸的物质的量浓度是2mol/L.
8.下列说法正确的是( )
| A. | 用钢瓶储存液氯或浓硫酸 | |
| B. | 通过灼热的铜网以除去H2中混有的O2 | |
| C. | Cu与浓硫酸反应终止后,冷却,向试管中加适量蒸馏水以观察水合铜离子的颜色 | |
| D. | pH小于7的雨水即为酸雨 |
15.下列有关化学用语表示正确的是( )
| A. | 质量数为35的氯原子:${\;}_{35}^{17}$Cl | |
| B. | 14C的原子结构示意图: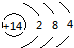 | |
| C. | N2分子的电子式: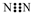 | |
| D. | 乙酸乙酯的结构简式为:CH3COOC2H5 |
12.元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用.下表列出了①~⑨九种元素在周期表中的位置.
请回答:
(1)以上元素中,最高价氧化物对应水化物酸性最强的是HClO4;碱性最强的是KOH;显两性的是Al(OH)3(填化学式)
(2)③、④、⑨三种元素按原子半径由大到小的顺序依次为K>Na>Mg(填元素符号)
(3)按要求写出下列两种物质的电子式:⑥的氢化物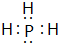 ; ⑨的最高价氧化物的对应的水化物
; ⑨的最高价氧化物的对应的水化物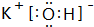 ;
;
(4)由H和①形成的原子数之比为1:1的物质H2O2 (填化学式).
(5)利用⑧的单质制备漂白粉发生反应的化学方程式为2Ca(OH)2+2Cl2═CaCl2+Ca(ClO)2+2H2O.
(6)⑤的最高价氧化物对应的水化物既能与③的最高价氧化物对应的水化物反应,也能与⑧的最高价氧化物对应的水化物反应.分别写出其反应的离子方程式是Al(OH)3+OH-=AlO2-+2H2O;Al(OH)3+3H+=Al3++3H2O.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 4 | ⑨ |
(1)以上元素中,最高价氧化物对应水化物酸性最强的是HClO4;碱性最强的是KOH;显两性的是Al(OH)3(填化学式)
(2)③、④、⑨三种元素按原子半径由大到小的顺序依次为K>Na>Mg(填元素符号)
(3)按要求写出下列两种物质的电子式:⑥的氢化物
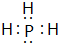 ; ⑨的最高价氧化物的对应的水化物
; ⑨的最高价氧化物的对应的水化物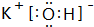 ;
;(4)由H和①形成的原子数之比为1:1的物质H2O2 (填化学式).
(5)利用⑧的单质制备漂白粉发生反应的化学方程式为2Ca(OH)2+2Cl2═CaCl2+Ca(ClO)2+2H2O.
(6)⑤的最高价氧化物对应的水化物既能与③的最高价氧化物对应的水化物反应,也能与⑧的最高价氧化物对应的水化物反应.分别写出其反应的离子方程式是Al(OH)3+OH-=AlO2-+2H2O;Al(OH)3+3H+=Al3++3H2O.
10.下列离子方程式的书写正确的是( )
| A. | 铁和稀硫酸反应 2Fe+6H+═2Fe3++3H2↑ | |
| B. | 向硫酸钠溶液中滴加氯化钡溶液 Ba2++SO42-═BaSO4↓ | |
| C. | 氯水加入到溴化钾溶液中 Br-+Cl2═Br2+Cl- | |
| D. | 碳酸钙溶于稀盐酸 CO32-+2H+═H2O+CO2↑ |
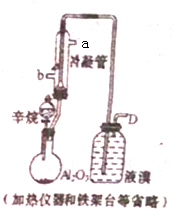 现以C8H18为原料经裂解制得乙烯,进而制得1,2.二溴乙烷,根据如图所示装置,结合有关知识回答问题:
现以C8H18为原料经裂解制得乙烯,进而制得1,2.二溴乙烷,根据如图所示装置,结合有关知识回答问题:
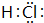 .
. 3,4-二甲基辛烷
3,4-二甲基辛烷 ,1mol该烃完全燃烧需消耗氧气18.5mol.
,1mol该烃完全燃烧需消耗氧气18.5mol.