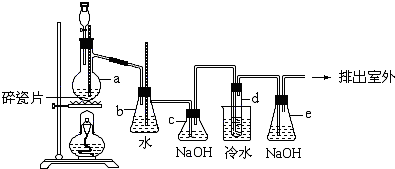
题目内容
17.我国西部地区蕴藏着丰富的锂资源,下列关于锂的叙述不正确的是( )| A. | 和锂同一主族的都是金属元素 | B. | LiOH的碱性比NaOH的弱 | ||
| C. | 锂的化学性质不如钠活泼 | D. | Li在空气中燃烧生成Li2O |
分析 Li与Na同主族,性质相似,但金属性Na>Li,结合性质的相似性和递变性来解答.
解答 解:A.和锂同一主族的不都是金属元素,第一周期为非金属元素氢元素,故A错误;
B.金属性Na>Li,可知LiOH的碱性比NaOH弱,故B正确;
C.同主族从上到下金属性增强,则锂的化学性质不如钠活泼,故C正确;
D.锂在空气中燃烧生成Li2O,不生成过氧化物,故D正确;
故选A.
点评 本题考查碱金属单质的性质,为高频考点,把握同主族性质的相似性和递变性为解答的关键,侧重分析与应用能力的考查,注意选项D为易错点,题目难度不大.

练习册系列答案
相关题目
8.下列说法正确的是( )
| A. | 用钢瓶储存液氯或浓硫酸 | |
| B. | 通过灼热的铜网以除去H2中混有的O2 | |
| C. | Cu与浓硫酸反应终止后,冷却,向试管中加适量蒸馏水以观察水合铜离子的颜色 | |
| D. | pH小于7的雨水即为酸雨 |
12.元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用.下表列出了①~⑨九种元素在周期表中的位置.
请回答:
(1)以上元素中,最高价氧化物对应水化物酸性最强的是HClO4;碱性最强的是KOH;显两性的是Al(OH)3(填化学式)
(2)③、④、⑨三种元素按原子半径由大到小的顺序依次为K>Na>Mg(填元素符号)
(3)按要求写出下列两种物质的电子式:⑥的氢化物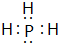 ; ⑨的最高价氧化物的对应的水化物
; ⑨的最高价氧化物的对应的水化物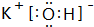 ;
;
(4)由H和①形成的原子数之比为1:1的物质H2O2 (填化学式).
(5)利用⑧的单质制备漂白粉发生反应的化学方程式为2Ca(OH)2+2Cl2═CaCl2+Ca(ClO)2+2H2O.
(6)⑤的最高价氧化物对应的水化物既能与③的最高价氧化物对应的水化物反应,也能与⑧的最高价氧化物对应的水化物反应.分别写出其反应的离子方程式是Al(OH)3+OH-=AlO2-+2H2O;Al(OH)3+3H+=Al3++3H2O.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 4 | ⑨ |
(1)以上元素中,最高价氧化物对应水化物酸性最强的是HClO4;碱性最强的是KOH;显两性的是Al(OH)3(填化学式)
(2)③、④、⑨三种元素按原子半径由大到小的顺序依次为K>Na>Mg(填元素符号)
(3)按要求写出下列两种物质的电子式:⑥的氢化物
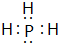 ; ⑨的最高价氧化物的对应的水化物
; ⑨的最高价氧化物的对应的水化物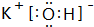 ;
;(4)由H和①形成的原子数之比为1:1的物质H2O2 (填化学式).
(5)利用⑧的单质制备漂白粉发生反应的化学方程式为2Ca(OH)2+2Cl2═CaCl2+Ca(ClO)2+2H2O.
(6)⑤的最高价氧化物对应的水化物既能与③的最高价氧化物对应的水化物反应,也能与⑧的最高价氧化物对应的水化物反应.分别写出其反应的离子方程式是Al(OH)3+OH-=AlO2-+2H2O;Al(OH)3+3H+=Al3++3H2O.
6.下列说法不正确的是( )
| A. | 沸点:正戊烷>2-甲基丁烷>丙烷 | |
| B. | 将铜丝在酒精灯上加热后,立即伸入无水乙醇中,铜丝恢复成原来的红色 | |
| C. | 相对分子质量相近的醇比烷烃沸点高是因为醇分子间存在氢键 | |
| D. |  的名称为2,2,4-三甲基-4-戊烯 的名称为2,2,4-三甲基-4-戊烯 |
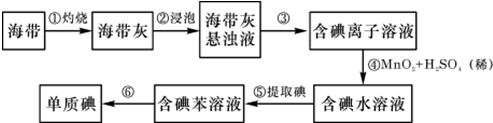
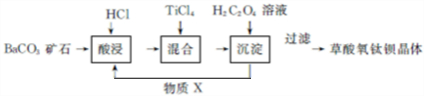
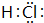 .
. 3,4-二甲基辛烷
3,4-二甲基辛烷 ,1mol该烃完全燃烧需消耗氧气18.5mol.
,1mol该烃完全燃烧需消耗氧气18.5mol.